(3)生殖補助医療
1)卵巣刺激法
ポイント
- 採卵は苦痛やリスクを伴い,仕事をしている患者にとっては社会的な負担になることから一度の採卵で複数の卵子を獲得できる可能性のある調節卵巣刺激を用いる場合がある.
- 患者の卵巣予備能や年齢,誘発前の胞状卵胞の数などから獲得卵子数と卵巣過剰刺激症候群(OHSS:ovarian hyperstimulation syndrome)のリスクを予想し,適切な調節卵巣刺激を行う必要がある.
生殖補助医療(ART)では,採卵を行うことにより,卵子を獲得することが重要であり,採卵には卵巣に対して,誘発刺激を行わない自然周期採卵と,誘発刺激を行う調節卵巣刺激採卵とがある.
自然周期のメリットとしては投薬などの身体的負担が少ないことや,卵巣過剰刺激症候群(OHSS)のリスクがなく,そのため新鮮胚移植が検討できることが挙げられる.デメリットとしては,獲得し得る卵子は1個程度となるため,調節卵巣刺激に比べ,採卵あたりの胚移植回数が少なくなる可能性があることである.胚まで到達できない場合は,再度採卵を行う必要がある.採卵は苦痛やリスクを伴い,また仕事をしている患者にとっては社会的な負担になるため,一度になるべく多くの卵子獲得を目指して,調節卵巣刺激が選択されることがある.
調節卵巣刺激には後述のごとく様々な方法があるが,卵巣刺激のデメリットは,FSH(卵胞刺激ホルモン)製剤などの使用により,OHSSのリスクが上昇することである.効果的かつ安全性を考慮した適切な卵巣刺激法を選択することが重要である.
以下に具体的な方法を列挙する.
①ゴナドトロピン放出ホルモンアゴニスト法(GnRHa法)【ロング法,ショート法】
ゴナドトロピン放出ホルモンアゴニスト法(以下,GnRH アゴニスト法)は,GnRH アゴニストを連日投与することにより,内因性のゴナドトロピン(LH:黄体形成ホルモン,FSH:卵胞刺激ホルモン)の放出を抑制し,結果的に自発的なLHサージを抑制する.また月経期よりゴナドトロピン製剤(hMGや,リコンビナントFSH)を投与することにより複数の卵胞発育を促す.主席卵胞が18mm程度になるまで刺激を継続し,排卵誘起(トリガー)を行う.排卵誘起の方法はヒト絨毛性ゴナドトロピン(hCG)製剤を用いる.排卵誘起の36時間以内に採卵を行う.排卵誘起時の血中エストラジオール(E2)の濃度によっては新鮮胚移植を選択することができるが,この場合,内因性のゴナドトロピンは抑制されているため,黄体補充は必須となる.
GnRH アゴニスト法の注意点としては,ほかの卵巣刺激法と比較してOHSSのリスクが高いという点にある.内因性のゴナドトロピンを抑制している性質上,排卵誘起はGnRH アゴニストを使ったflare up(一過性の内因性ゴナドトロピンの分泌亢進)を利用した方法はとることができず,前述のようにhCG製剤を用いる方法となる.
GnRH アゴニスト法にはロング法とショート法があり,GnRH アゴニスト製剤の使用を始めるタイミングが異なる.
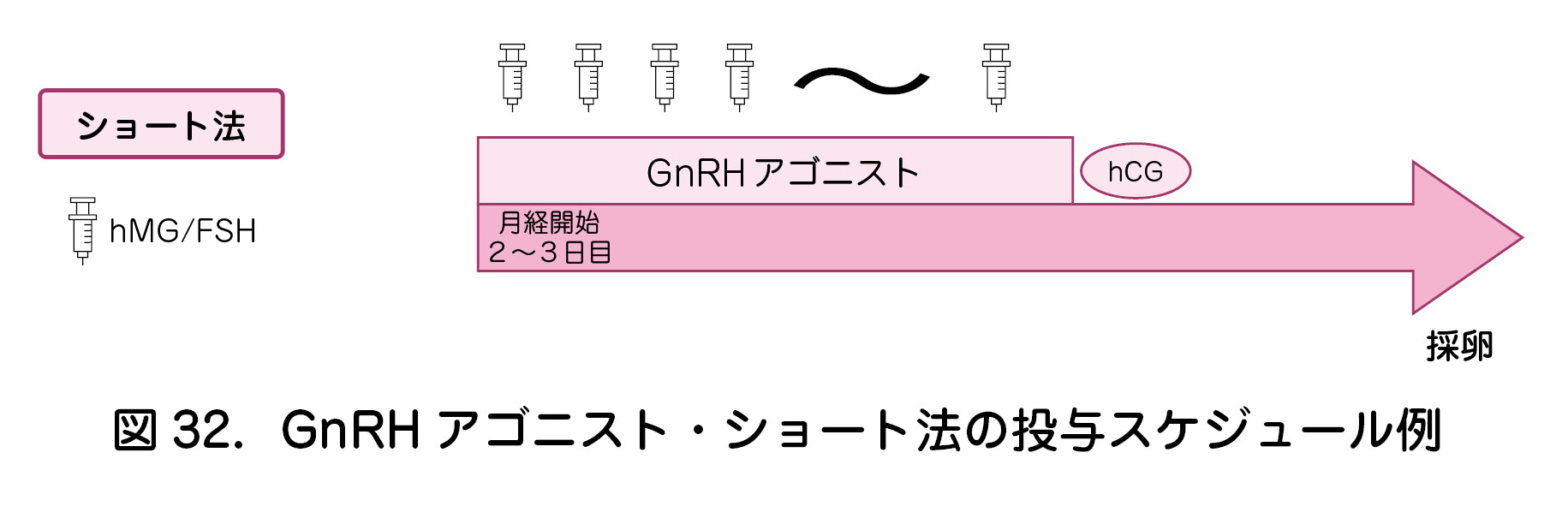
a.ショート法(図32)
- 卵巣機能が軽度低下した症例で適用されることが多い.
後述のロング法で卵巣の反応性が悪かった場合にも適応となる. - GnRH アゴニスト投与を開始した初期段階でのflare up 効果により卵胞発育を促進する.flare up 効果は一時的であり,その後,GnRH アゴニストはLHサージを抑制するように働く.
- 早発LHサージ抑制効果が弱く,採卵前に排卵してしまうリスクがロング法より高い.
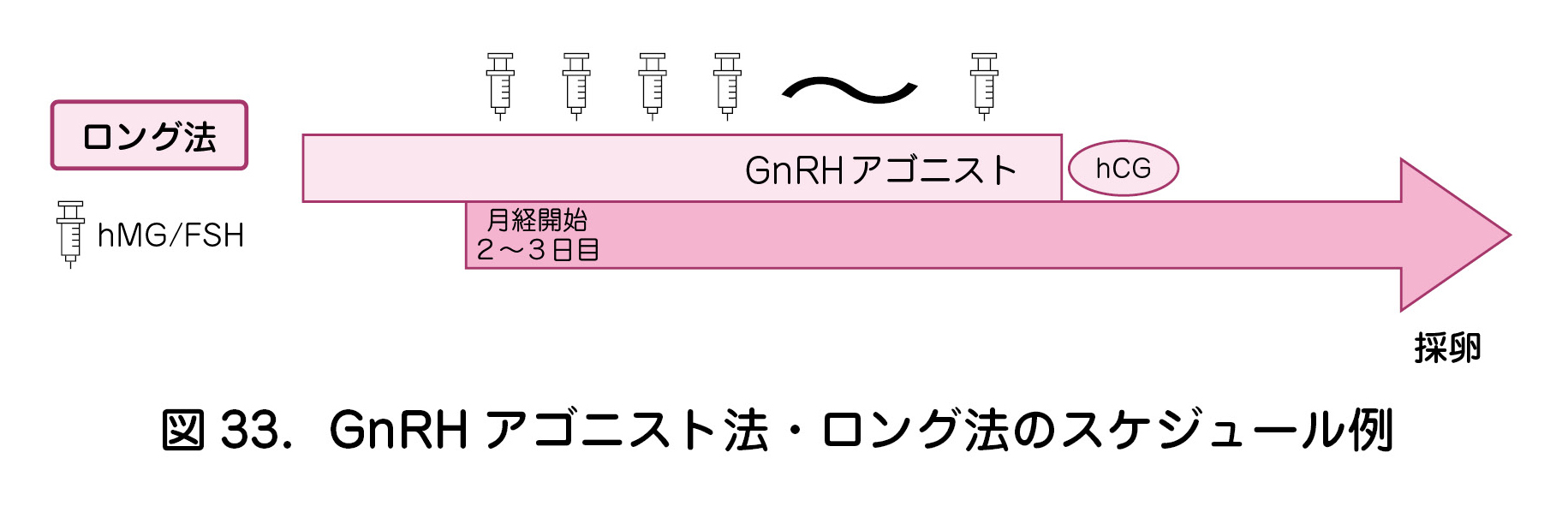
b.ロング法(図33)
- GnRH アゴニスト法の中では最も古典的な方法である.
- 卵巣予備能が比較的保たれている場合に適用される.
- 早発LHサージをほぼ確実に抑制できる(ショート法よりも長時間下垂体抑制をかけるため).
- 内因性のゴナドトロピンを抑制するためゴナドトロピン製剤の必要量が多くなる.
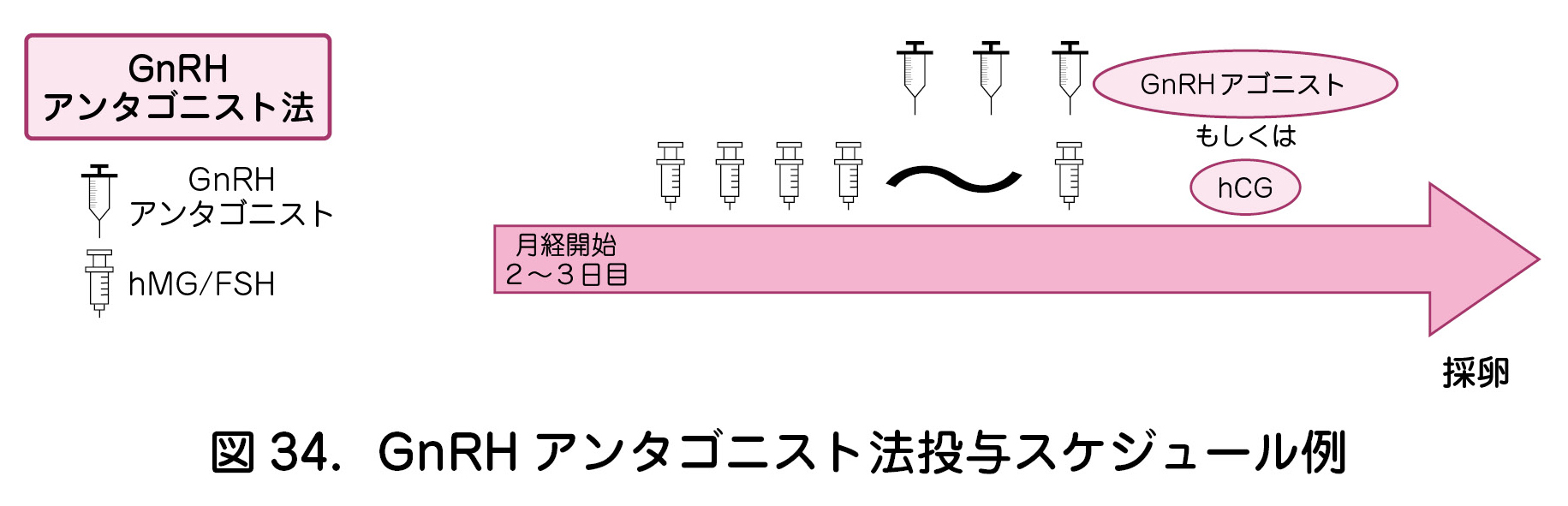
②ゴナドトロピン放出ホルモンアンタゴニスト法(GnRHアンタゴニスト法)(表11,図34)
ゴナドトロピン放出ホルモンアンタゴニスト法(以下,GnRHアンタゴニスト法)は月経3日目程度からhMG製剤,もしくはFSH製剤を用いて卵巣刺激を行い,主席卵胞径が14~15mmに達した段階からGnRHアンタゴニストの投与を併用することにより,内因性LHサージを抑制しつつ卵胞発育を促す方法である.
主席卵胞が18mm以上に到達したら,排卵誘起を行い,約36時間以内に採卵する.トリガーに関しては,hCG製剤を用いる方法のほか,GnRH アゴニストを用いる方法,両者を併用する方法(dual trigger)も選択することができる.
OHSSのリスクが高い場合は,トリガーにGnRH アゴニストを用いることによりリスクを軽減できる.また,OHSSのリスクが高い場合には全胚凍結が推奨される.

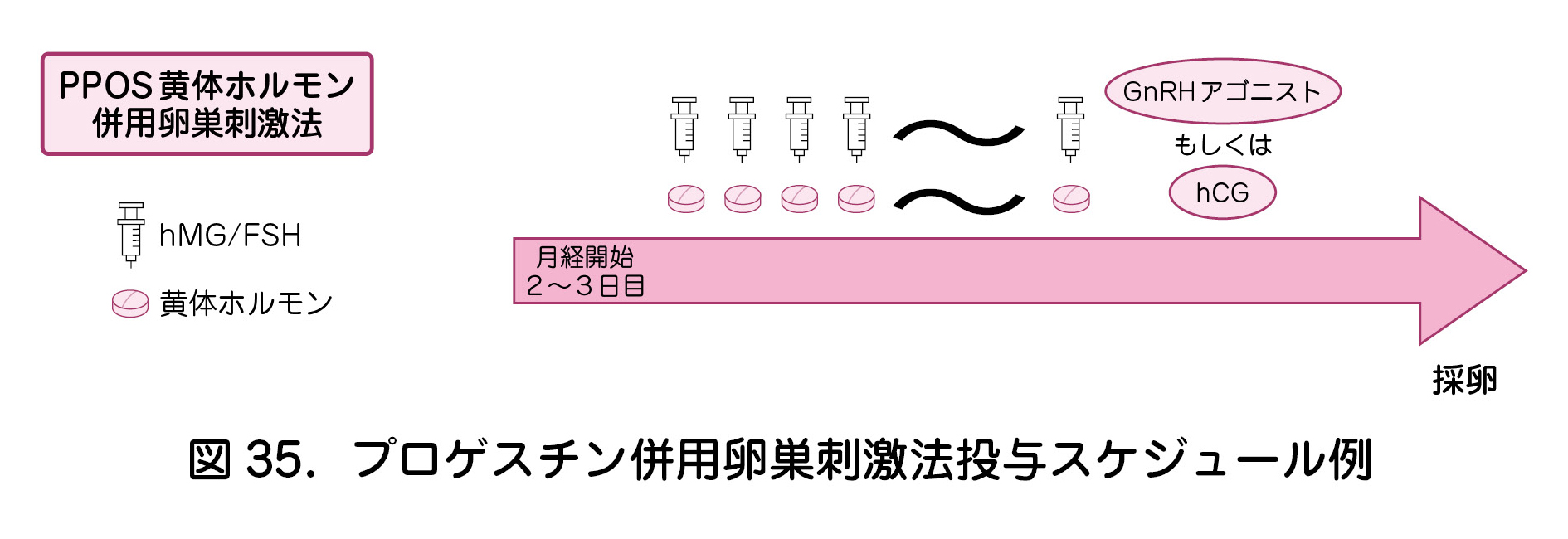
③プロゲスチン併用卵巣刺激法(PPOS:progestin primed ovarian stimulation 法)(表12,図35)
プロゲスチン併用卵巣刺激法(PPOS法)はプロゲスチン製剤を用いて内因性のLHサージを抑制する方法である.月経3日目頃よりhMG製剤もしくはFSH製剤にて卵巣刺激を行いつつプロゲスチン製剤の連日投与を併用する.
メリットとして,プロゲスチン製剤はGnRHアンタゴニスト製剤と比較し安価である点,GnRHアンタゴニスト法ではアンタゴニスト併用開始のタイミングがポイントとなるが,PPOS法ではその点を考慮する必要がないことが挙げられる.
トリガーに関しては,hCG製剤を用いる方法,GnRH アゴニストを用いる方法,両者を併用する方法を選択することができる.OHSSのリスクが高い場合は,GnRH アゴニストを用いることによりリスクを軽減できる.
早期からプロゲスチン製剤を投与するため,新鮮胚移植はできず,OHSSのリスクにかかわらず全胚凍結となる.
生殖医療ガイドラインでは,PPOS法は比較的新しい方法であるため,安全性・有効性を注視する必要があるとされている.

④最適な卵巣刺激方法の選択
卵巣刺激方法は患者の年齢,卵巣予備能,不妊原因,夫の精子所見,本人希望などを考慮しながら決定する.年齢が高く,卵巣予備能が低い場合には獲得できる卵子の数が少ない可能性があり,刺激を強く行ってもOHSSのリスクは低い可能性がある.また,夫の精子所見が不良であり,受精障害が強く受精卵の獲得に難渋する場合は,より多くの卵子を獲得しておきたい.
しかしながら同じ患者でも周期によって卵胞の育つ数やスピードも違うケースもあり,刺激の程度の調節や次回の外来のタイミングなどで悩むケースもある.
リスクのある調節卵巣刺激は安全面を最も考慮すべきであり,代表的な合併症のOHSSは重症例では脳梗塞や肺塞栓を起こす例もある.重症なOHSSを避けることを第一に考えて誘発を行うべきである.
⑤ART専門施設と一般産婦人科・診療所の連携
ARTは専門施設で行われており,一般施設からARTへステップアップする場合,スムーズな連携が重要である.
患者の最初の受診先は一般の診療所の可能性もある.患者の希望が最も優先されるが,一般不妊治療での妊娠が難しいようであれば,必要に応じてART専門施設に紹介する必要がある.必要なら早期の紹介も考慮される.
紹介のタイミングは医師,患者間でしっかりと相談のもと行われるかと思うが,明確な医学的な紹介するべきタイミングもなく,判断に苦慮することはあるかもしれない.
スムーズな連携を支えるフェムテックなどはこれから注目されるべきであろう.
参考となる文献
- 1)黒田恵司.データから考える 不妊症・不育症治療 改訂第2 版.154-160
- 2)日本生殖医学会.生殖医療の必修知識.320-325,2020
- 3)京野廣一.排卵誘発-誘発派.産婦人科の実際.58:1806,2009
- 4)高橋克彦.GnRH アンタゴニストの効果的応用,今日の不妊診察.医歯薬出版.195,2004
- 5)日本生殖医学会.生殖医療ガイドライン.23-56
- 6)中尾佳月,高見澤聡,他.採卵決定日にLH サージが開始された採卵周期におけるレルゴリクスの排卵抑制効果. 日本IVF 学会誌.23:24-26,2020
参考資料
以下,生殖補助医療管理料に関する厚生労働省の疑義解釈資料の抜粋である.
令和4年3月31日
疑義解釈資料の送付について(その1)
問37 生殖補助医療管理料の治療計画については、当該管理料を算定する保険医療機関において治療を完結させる必要があるのか。例えば、治療計画の作成等をA病院で行い、採卵準備等のための外来診療(頻度の高い投薬等)については患者のかかりつけのBクリニックで実施する場合、A病院は当該管理料を算定できるか。
(答) 算定可。この場合、Bクリニックにおける治療の内容を含めて、治療計画に記載した上で、患者及びそのパートナーの同意を得ること。また、A病院においては、Bクリニックにおける診療内容について、患者から都度聴取し、必要に応じてBクリニックに照会すること。
令和5年1月12日
疑義解釈資料の送付について(その37)
問5 3月31日事務連絡別添2問37における「排卵準備等のための外来診療(頻度の高い投薬等)」について、Bクリニックが排卵誘発のための在宅自己注射に関する指導管理を行った場合も含まれるか。
(答) 含まれる。
問6 3月31日事務連絡別添2問37の例において、A病院で生殖補助医療に係る計画的な医学管理を行っている患者に対し、当該計画に基づき、Bクリニックが診療及び自己注射に関する指導管理等を行った場合、Bクリニックにおいて生殖補助医療管理料は算定可能か。また、Bクリニックにおいて初診料又は再診料、処置、検査又は投薬等に係る項目、及び在宅自己注射指導管理料については算定可能か。
(答) 生殖補助医療管理料は算定不可。また、初診料又は再診料、処置、検査又は投薬等に係る項目、及び在宅自己注射指導管理料については、要件を満たした場合にはそれぞれ算定可能。
このように2つの医療機関をまたぐ加療は保険診療においても可能となっている.保険診療下での生殖補助医療は現状,専門施設のみで行われているが,今後は一般の産婦人科施設との連携も重要となってくるだろう.
2)採卵
ポイント
- 採卵は体外受精において,患者にとって最も侵襲的な手技と認識する.
- 痛みを伴うこと以外にも腹腔内出血,他臓器損傷,感染などの合併症を生じる可能性があることを十分に説明し,同意を得ることが重要である.
- 採卵施行前に必ず採卵におけるリスク評価を行う.
- 過去に手術や麻酔で何か問題が起きたことがあるか
緊急事態を想定し,ぐらついている歯などがないかなども聴取. - 以下の既往歴を確認する.喘息などでは,最終発作の時期も確認する.
- 喘息・呼吸器疾患・てんかん・脳神経疾患・甲状腺疾患・精神疾患・脂質代謝異常症
- 抗リン脂質抗体症候群・前兆のある頭痛・肝臓/腎臓疾患・心疾患・緑内障・高血圧
- 糖尿病
- 現在の内服薬,常用薬,喫煙の有無
- 易出血傾向の有無
- アレルギーの有無
- 過去に手術や麻酔で何か問題が起きたことがあるか
- 採卵周期に至るまでに十分な説明と問診がなされていても,患者の認識と異なる場合もあるため,少なくとも2回以上手術リスクを聴取し,安全確認を徹底する.
- 初診時にリスク評価を行った場合も,聴取できていなかったリスク要因が新たに見つかるケースも少なくないため,採卵周期開始時に再度リスクの最終評価を行う.
①採卵(図36)
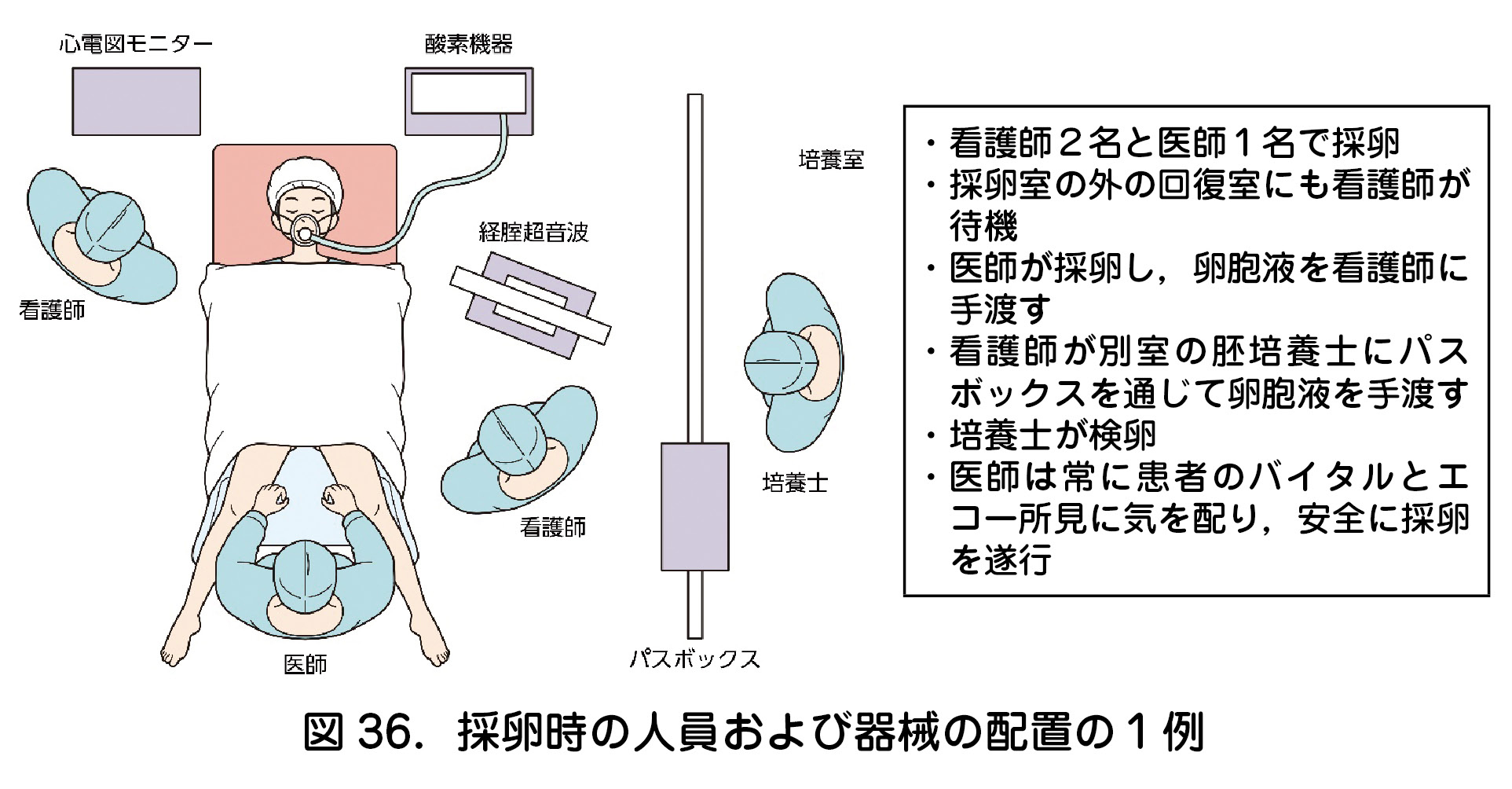
②採卵に関する合併症
- 代表的な合併症として,出血,感染,他臓器損傷などが挙げられる.
- 患者の近隣のクリニック,もしくは高次医療機関との連携が必須である.
- 下記の合併症によりクリニックでの管理が難しいと判断した場合には高次医療機関へ,その後の加療を依頼する必要がある.
- 緊急手術が必要な状況なのか,ICU管理が必要と予想されるのか,あるいは外来管理で対応可能なのか,患者の病態を評価して高次医療機関へ情報提供することが望ましい.
- 採卵は侵襲的な手技である.患者の安全を第一に考え,無理な穿刺をしないことが肝要.
a.出血
- 穿刺する際には,穿刺する方向に血管があるかどうかカラードプラで確認し,明らかな血管がある場合は避けて穿刺する.
- カラードプラ上,明らかな血管がなくても採卵により腟壁から出血することも多く,しっかりと止血を確認し,採卵を終える必要がある.
- 予想外に出血が多い場合などは,時間をおいて超音波検査などを行い,問題のないことを確認する.
- 採卵の段階では問題がないと判断しても出血が持続する可能性もある.採卵後は回復室で休息の上,定期的にバイタルサインを確認する必要がある.ナースコールも患者の手の届く場所に置き,有事の際にはすぐに対応できる準備をしておく必要がある.
- 血腫を形成すると,その血腫が感染を起こす可能性があるため注意が必要である.
b.感染
- 処置に伴う感染のリスクがある.重篤な感染の頻度としては,0.03~0.77%と報告されている.
- 子宮内膜症性卵巣囊胞などの子宮内膜症を合併している場合には感染のリスクが高まる.
- 採卵時に抗菌薬を使用しても感染を引き起こすことがあり,採卵周期が始まる前にリスクについて十分な説明をし,同意を得ることが重要である.
- 子宮内膜症性囊胞が穿刺に伴い破裂した場合には腹膜刺激症状が出現し,入院加療が必要になることもある.
c.他臓器損傷
- 穿刺により他臓器を損傷するリスクがある.代表的な損傷部位は腸管,膀胱,血管などである.頻度としては,0.01~0.1%と報告されている.
- 腸管を穿刺,損傷した場合,重篤な腹腔内感染を引き起こす可能性がある.処置後に感染様症状を引き起こした場合には,重症化する可能性を考慮し,対策を検討する.
- 膀胱を穿刺,損傷した場合,自覚症状として血尿を伴う可能性がある.経過観察で回復する可能性もあるが,血腫や感染のリスクも高まるので注意を要する.
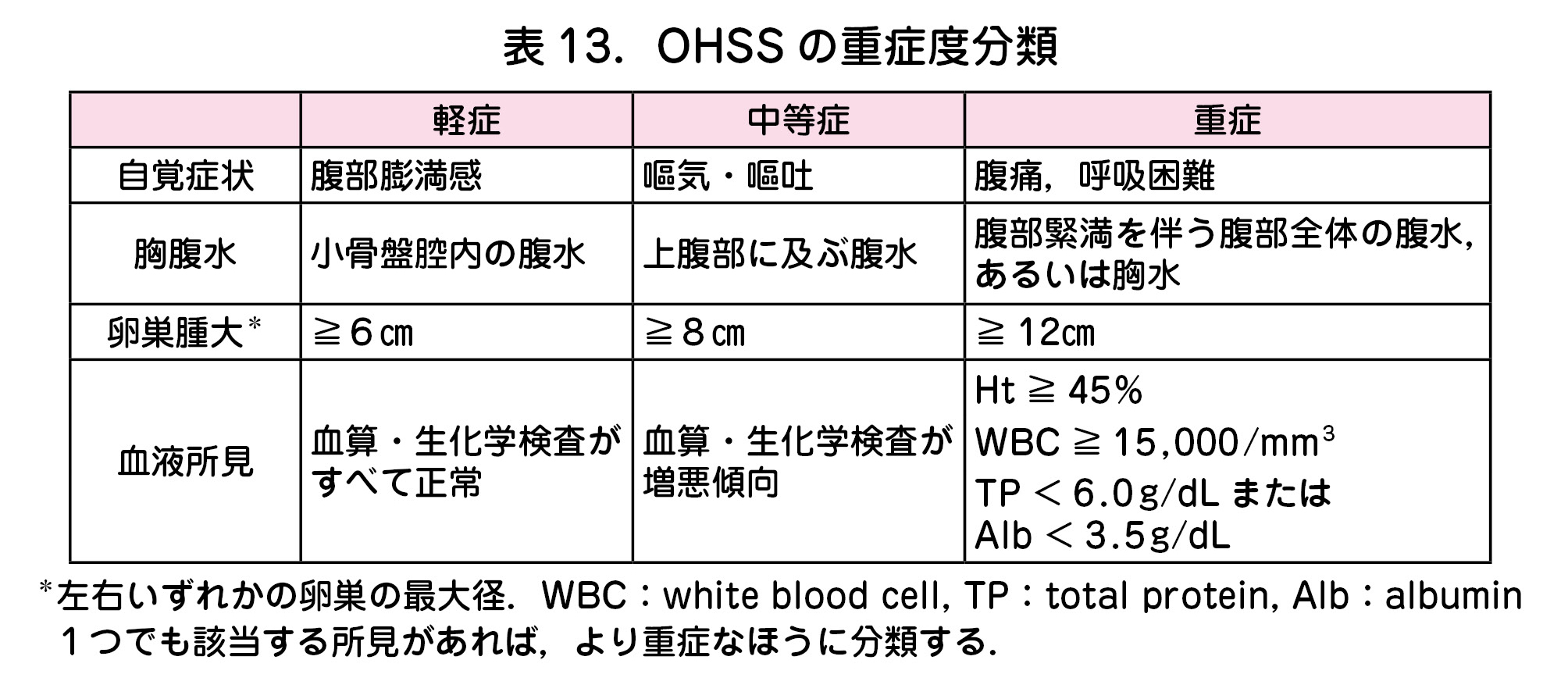
d.卵巣過剰刺激症候群(OHSS:ovarian hyperstimulation syndrome)
- 『生殖医療の必修知識』のOHSSの重症度分類を記載する(表13).
- OHSSが重症化すると左右の卵巣が手拳大,もしくはそれ以上に肥大し,腹水貯留,著明な腹部膨隆が起こる.患者の自覚症状としては腹部膨満感,体重増加,浮腫などがある.さらに重症化すると血管内脱水が起こり,血液が濃縮する.結果として尿量が減少する.
- さらに重篤化すると血栓症(脳梗塞,肺塞栓症),腎障害,高カリウム血症による不整脈,胸水が貯留して呼吸困難が起こることもある.生命にかかわる可能性もあり,必要に応じて入院加療を行う.
- 治療は補液を行い,重症例に関してはCART療法(腹水ろ過濃縮再静注療法)などの低蛋白血症対策,電解質補正などが必要となる可能性がある.
- 多囊胞性卵巣症候群(PCOS:polycystic ovary syndrome)は代表的なOHSSのリスク因子である.胞状卵胞数が多いことや高いAMHなど高い卵巣予備能を示す所見も,これらの数や数値の増加とともにOHSSのリスクは高くなるため注意が必要である.
- 新鮮胚移植による妊娠が成立した場合にはさらに重篤化の危険性と,妊娠6~8週頃まで軽快しない可能性があるため,OHSSのリスクが高い場合には新鮮胚移植は行わず,全胚凍結を選択することが重要である.その場合は次回の月経には軽快する.
- OHSSのリスクが高い場合,採卵時にOHSSの発症抑制として薬剤の使用も検討できる.
- 保険診療で認められるOHSSの発症抑制として下記がある.
- カベルゴリン0.5mgを卵子成熟(トリガー)のhCGまたはGnRH アゴニスト投与開始日または採卵後から7~8日間経口投与する.
- さらにOHSSの発症リスクが高い症例に対しては,ガニレリクス酢酸塩【注射薬】を原則として採卵日当日から5日間,ガニレリクスとして0.25mgを1日1回皮下に連日投与する.
- レトロゾールの使用も認められるが,令和4年3月16日の厚生労働省保険局医療課から通達の事務連絡に記載があるのみで使用量などの定めは現時点でははっきりしていない.
参考となる文献
- 1)黒田恵司.データから考える 不妊症・不育症治療 改訂第2 版.161-164
- 2)日本産科婦人科学会,生殖・内分泌委員会報告.卵巣過剰刺激症候群の管理方針と防止のための留意事項. 日本産科婦人科学会雑誌.61:1138-1145,2009
- 3)日本生殖医学会編.生殖医療の必修知識.東京,杏林舎.326-331,447-457,2023
- 4)柴原浩章,平野由紀,町田静生,平嶋周子,高見澤聡,鈴木光明.女性診療科医のための薬物療法マニュア ル 婦人科の薬物療法,生殖・不妊・避妊,卵巣過剰刺激症候群.産婦人科治療.86:667-674,2003
- 5)日本生殖医学会.生殖医療ガイドライン.57-61
3)体外受精・顕微授精
ポイント
- 体外受精にスプリット法やレスキューICSIを併用することで,完全受精障害を防ぐことが可能である.
- 顕微授精は重症の男性因子や体外受精で完全受精障害となった場合などに行う.すべての卵子に行うメリットは示されていない.
①体外受精・顕微授精に関する基礎知識
- 採卵された卵子と精子の受精を促す行為を媒精という.
- 媒精方法には,卵子が入った培養液に一定濃度の運動良好精子を入れて受精成立を期待する体外受精(conventional IVF)と顕微鏡下に卵子に精子を注入する顕微授精(micro-insemination)とがある.
- 顕微授精法として種々の方法が試みられてきたが,現在はそのほとんどが卵細胞質内精子注入法(ICSI:intracytoplasmic sperm injection)であり,「顕微授精(ICSI)」と表現される場合も多い.
- 複数個採卵された場合に卵を体外受精と顕微授精とに分け,媒精を行うスプリット法もある.
- 採卵直後の卵子は第二減数分裂中期(MⅡ:MetaphaseⅡ)期に入っているものの,完全成熟のためには媒精を行う前に3~6時間,培養器内で前培養を行う.
- 射出されたばかりの精子には受精能はなく,通常腟内で射精された精子が腟,子宮頸管,子宮体部,卵管と進んでいく過程で精子は運動能を増し,受精能を獲得していく.よって体外受精においては受精能獲得のために精子処理を行う必要がある.
②体外受精(Conventional IVF)
a.適応
- 日本産科婦人科学会の会告では「本法(体外受精・胚移植)は,これ以外の治療によっては妊娠の可能性がないか極めて低いと判断されるもの,および本法を施行することが,被実施者またはその出生児に有益であると判断されるものを対象とする」とされている.具体的には,卵管性不妊,乏精子症・精子無力症などの男性不妊,抗精子抗体を有するなどの免疫性不妊,子宮内膜症,原因不明不妊,高齢の場合などが適応となる.
b.方法
- 体外受精のための採精は,自宅ないし院内の採精室で行う.採精から良好精子回収処理までの時間が3時間を超えると精子の運動率と生存率が低下する1).また採精後2時間くらいまでであれば,自宅採精でも院内採精でも治療成績には差がない2).よって自宅採精の場合,採精後2時間,遅くとも3時間以内には精液処理を開始する必要がある.
- 採精は専用のプラスチックカップ(図37)に行うことが多い.採精後は30~60分間常温におき,精液を液化させた後に処理を開始する.
- 乏精子症・精子無力症など男性因子を有する場合には,自宅・院内いずれの採精でも可能な限り速やかに精液処理を開始することが望ましい.
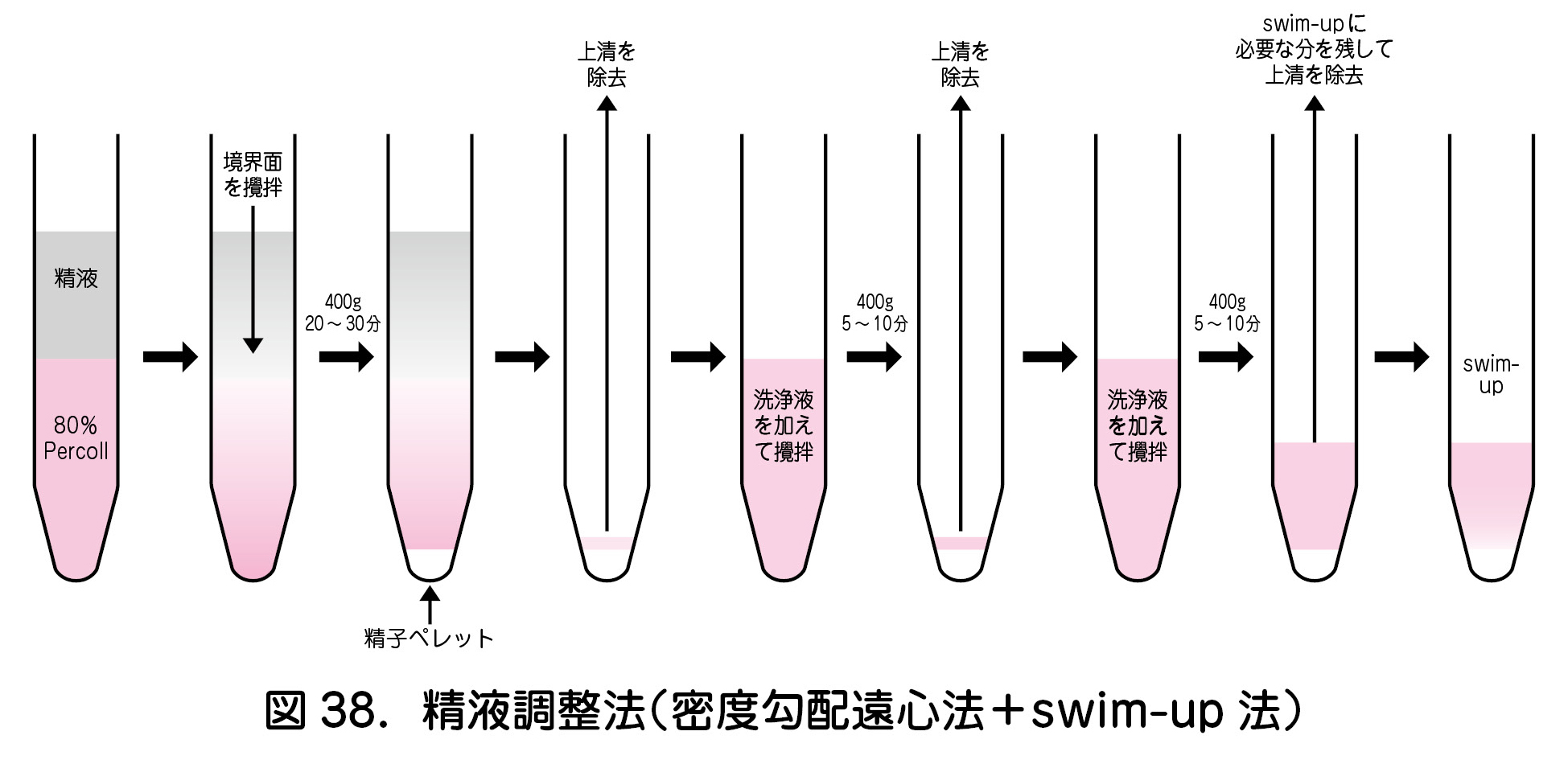
- 精子調整の目的は,精液中の白血球や細菌,死滅精子を取り除き,運動良好精子を回収することにある.これには,生存精子と死滅精子の密度の違いを用いる密度勾配遠心法や試験管内を泳ぎあがった運動良好精子を用いるswim-up法,そしてこれらを組み合わせた方法が用いられている(図38).重度の乏精子症,奇形精子症,または精子無力症の場合,密度勾配遠心法の方が回収される運動精子の総数が多い3).
- 採卵された卵子卵丘細胞複合体(COC:cumulus-oocyte complex)に対して,受精用培養液中で5~20万/mLになるよう調整した精子で媒精を行う.
- 媒精後17~20時間培養し,媒精の約18時間後に受精を確認(前核の出現を確認)する.
- タイムラプス胚培養システムを用いる場合などは媒精後3~4時間程度で顆粒膜細胞を除去し,培養に供する.この場合でも受精率は低下せず,むしろ胚の質が向上するとの報告がある4).

③顕微授精
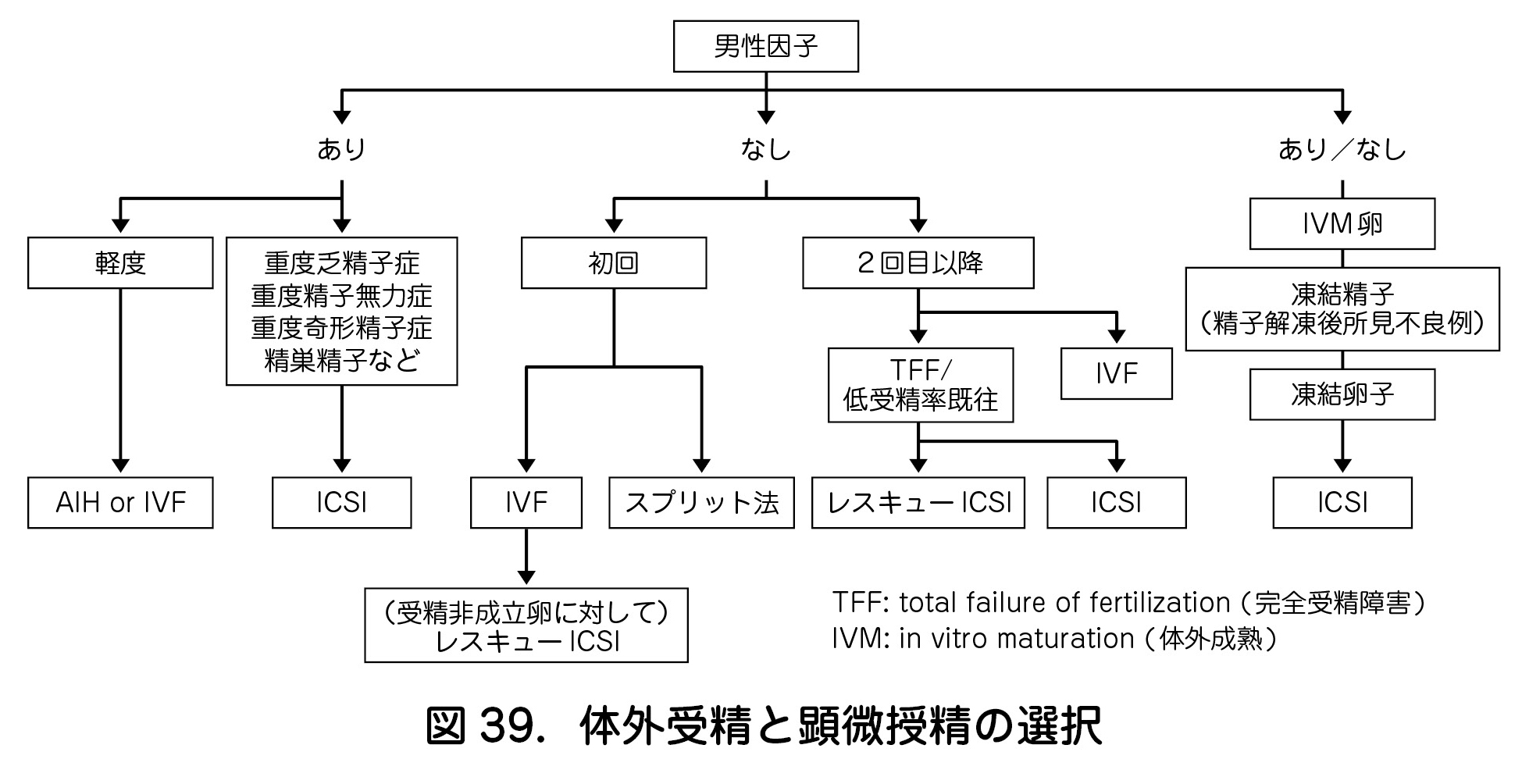
a.適応
- 顕微授精は,男性不妊や受精障害など,顕微授精以外の治療によっては妊娠の可能性がないか極めて低いと判断される場合に行われる.すなわち Conventional IVF では受精が成立しないもの,あるいは受精障害が予測されるものが適応となる.具体的には,重度の乏精子症・精子無力症・奇形精子症,精巣精子を用いる場合などが挙げられる(図39).
- 重度の男性不妊症や受精障害がない場合には,すべての卵にICSIを行うことが有用であるエビデンスはない.女性の年齢が高い場合や卵子数が少ない場合にもICSIが行われているが,ICSIを行うことで臨床成績がよくなるわけでもない.原因不明不妊症に対するICSIも,受精率向上には寄与するが,生産率が増加するわけではない5).
- 体外受精で受精率が低かったあるいは受精が成立しなかった場合や体外成熟(IVM:In vitro maturation)卵や凍結卵子を用いる場合,ICSIは受精率を向上させるために有用である5).
b.方法
- 第二減数分裂中期の卵に対してICSIを行う.
- インジェクションピペットやPiezoパルスを用いて精子不動化処理を行い,卵細胞膜を穿破して不動化精子を卵細胞質内に注入する.
- 細胞膜穿破方法:細胞膜を吸引する,メカニカルに穿刺(2回穿刺)する,Piezoパルスを使用する方法がある.細胞質吸引により卵細胞質にダメージが及ぶ可能性があるので,なるべく細胞質への負担が少ない方法を検討する必要がある.
c.利点
- ICSIの利点は受精障害の回避である.Conventional IVF による受精障害の多くをICSIで解決できる.
④スプリット法とレスキューICSI
a.適応
- 体外受精を行うと一般には70%程度の卵は受精成立するが,体外受精では全く受精が成立しない完全受精障害(TFF:total fertilization failure)の例が存在する.可能な限りTFFを避けるような媒精方法を検討する.
- 採卵された卵を体外受精と顕微授精に分けて行うスプリット法はTFFを防ぐためによい方法である.ただし,実際にTFFとなるのは5~30例に1例ほどである5).媒精する卵子が4個未満では Conventional IVF でもICSIでも受精率が低下するので,各々4個以上行うことが望ましい6).なおスプリット法も保険適用とされている.
- 体外受精(媒精)を行った数時間後に卵丘細胞を除去し,第二極体の放出および紡錘体を観察し,受精と判断できなかった場合にICSIを行うのがレスキューICSIである.もともとは媒精16~20時間後に前核が確認できなかった際にICSIを行う1day old ICSIとして報告されたが,本法では卵のエイジングにより良好な成績が得られなかった.これに対し媒精後4~6時間程度で受精徴候を確認するレスキューICSIは,受精やその後の胚発生,臨床成績は通常のICSIと変わらない.ただし,午前中に採卵し,2~3時間程度の前培養時間をおいて昼頃に媒精したとすると,レスキューICSIを行う時間は夕刻以降になってしまう.レスキューICSIは非常に有用な方法であるが,人手が少ない施設では導入しにくいのが現状である.
b.利点
- スプリット法,レスキューICSIともに,Conventional IVF の利点を残しながらTFFを予防できる.
文献
- 1)Appell RA, Evans PR. The effect of temperature on sperm motility and viability. Fertil Steril. 28: 1329- 1332, 1977
- 2)Sacha CR, Vagios S, Hammer K, Fitz V, Souter I, Bormann CL. The effect of semen collection location and time to processing on sperm parameters and early IVF/ICSI outcomes. J Assist Reprod Genet. 38: 1449- 1457, 2021
- 3)Chapter 5 Sperm preparation techniques. WHO laboratory manual for the examination and processing of human semen Sixth Edition. 161-170, 2021
- 4)日本生殖医学会編.体外受精(精子調整法と媒精他) 生殖医療の必修知識.東京,杏林舎.332-336,2023
- 5)Practice Committees of the American Society for Reproductive M, the Society for Assisted Reproductive Technology. Electronic address aao. Intracytoplasmic sperm injection(ICSI)for non-male factor indications: a committee opinion. Fertil Steril. 114: 239-245, 2020
- 6)柳田薫,柿沼俊行.柴原浩章編著.IVF 受精障害への対策 不妊症・不育症診療.東京,中外医学社.444- 446,2019
4)胚培養・胚凍結・融解
ポイント
- 胚培養の際には,培養液と培養環境(温度,pH,浸透圧など)の管理に注意する.
- ガラス化法における胚凍結・融解は,作業手順と各工程での作業時間を遵守することにより,細胞内の水晶形成を防ぐことが必須である.
①胚培養
a.胚培養とは
体外受精や顕微授精後,培養液内で胚を発育させる過程が胚培養であり,受精して胚となってから胚移植または胚凍結保存までの期間が該当する.胚発育は,通常卵管および子宮内での一連の過程であるが,体外培養では生体内とは異なる環境で発育することになり,様々なストレスに曝される.これらのストレスを最小限に抑制することが胚培養の最重要課題となっている.
b.培養法
培養法には sequential culture と single-step culture がある.胚の発育に必要な栄養素として,8細胞期以前の胚ではアミノ酸は利用せず,ピルビン酸や乳酸を主なエネルギー源としている.一方,8細胞期以後は,グルコースが主なエネルギー源となり,アミノ酸が必要になる.このように胚発育とともに必要な栄養素の違いから,従来では8細胞期までとそれ以降の培養液組成を変える sequential culture が行われてきた.しかし,胚自身が必要とするエネルギー源や物質を選択して吸収できることが判明したので,受精から胚盤胞までの培養液組成を変えない single-step culture が開発された.この培養液の登場により,培地交換による温度やpHなどの培養環境の変化を抑制して,胚へのストレスを最小限に抑えることが可能となった.特に,タイムラプスシステムでは,経時的に胚の形態変化を培養器内で記録できるため,インキュベーターの開閉を要さず,胚へのストレスが少ない培養法と考えられている.sequential culture と single-step culture を比較した報告では,胚盤胞への発育に有意差を認めないので,培養液管理の煩雑さやコスト削減が考慮され,single-step culture の利用が普及している.
c.血清およびアルブミン
胚は無血清培地での発育が可能であるが,アルブミンなど高分子化合物の添加により,胚発育の成績向上が期待されている.最近は,蛋白含有の培養液が使用可能となっているが,ヒト血清アルブミンの感染リスクやロット間バリエーションを回避するため,組み換えヒトアルブミンが使用されるようになっている.
d.培養環境
ア 温度
温度は37℃を維持する.温度の変動により胚は可逆性の変化を起こし,受精率の低下,胚発育の遅延,妊娠率の低下につながる.
イ pH 緩衝系
ヒト胚の細胞内pHは7.1~7.2である.ヒトの生体内では,呼吸によりCO2濃度を調節することで,血液中pHを生理的範囲に維持している.細胞培養の際にもインキュベーター内のCO2濃度を調節することで,培養液pHを一定レベルに維持する.
ウ 浸透圧とカバーオイル
培養液の浸透圧は,胚発育に大きな影響を与える.オイルでカバーしない場合,蒸発によって液中の浸透圧が上昇することを防ぐためには0.5~1mLの培養液が必要となる.一方,オイルでカバーする場合には,より少量の20~250μLの培養液で十分である.オイルは温度や浸透圧の変化だけでなく,大気中の微粒子や細菌の混入を防ぐ役割を担っている.粘性と純度の高さから,ミネラルオイルが選択される.
エ 酸素濃度
大気中の酸素濃度は20%であるが,哺乳動物の卵管や子宮内の酸素濃度は2~8%と低酸素環境である.哺乳動物の胚を用いた様々な実験結果から,20%酸素濃度で培養すると胚発育に悪影響を及ぼすことが知られており,ヒト胚培養も5%前後の酸素濃度で行う必要がある.
オ 光
哺乳動物の胚発育において,光は胚盤胞におけるアポトーシスの頻度を上げると報告されている.蛍光灯から放出される低波長光も有害と考えられており,最近ではLEDが光源として使用される.
カ グループ培養
いくつかの胚を同じ培養液内で培養すると,パラクライン効果により胚発育が良好となる.このため,複数の胚を同じ培養液で培養するグループ培養が主に用いられる.またタイムラプスシステム専用であるが,胚を識別しながらグループ培養可能なディッシュも開発されている.
②胚凍結・融解
ヒト生殖補助医療(ART)において,胚凍結は重要な治療技術の1つである.1983年に世界で初めてヒト凍結胚による妊娠・出産が成功して以降,胚凍結は広く臨床応用されている.従来,胚や卵子の凍結保存は緩慢凍結法が用いられてきたが,1985年ガラス化法(超急速凍結法)による胚凍結の成功により,簡便かつ短時間で凍結可能なガラス化法が主流となった.
凍結によって胚が障害される主な原因は,細胞内での氷晶形成が挙げられる.緩慢凍結法では,冷却過程で細胞外の水を凍結させ,耐凍剤浸透圧が上昇する.その結果,細胞内からの脱水が進行して,細胞外に形成される氷晶が細胞膜に物理的なダメージを与え,融解後の胚生存率が低下する.一方,ガラス化法は,高濃度耐凍剤(EG:エチレングリコール,DMSO:ジメチルスルホキシドなど)を使用し,-196℃の液体窒素に浸漬して急速冷却する.細胞内外の氷晶形成が抑制されるとともに,凍結融解の所用時間が短縮され,さらに融解後の高い生存率を得ることが可能となった(表14).
代表的なヒト胚凍結保存法の1つであるCryotop®法を例として,実際のガラス化法の実施過程について紹介する(図40).

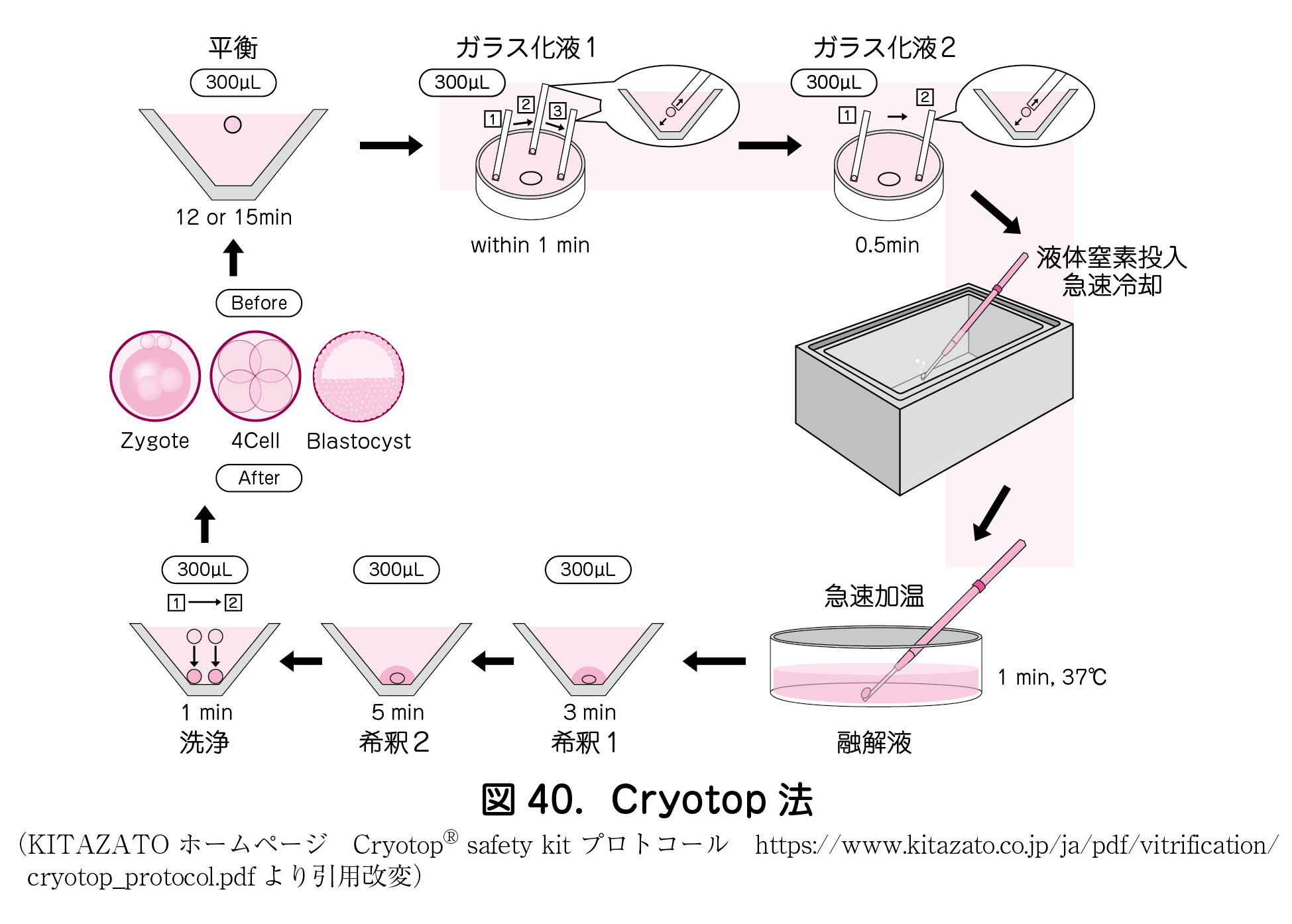
a.凍結保護物質の細胞内浸透・平衡化
胚を平衡液面の表面にのせる.胚は30秒以内に沈降しながら収縮していき,次に再拡張する.この過程では凍結保護物質を細胞内に浸透させ,細胞内外を平衡化させる.通常は室温下で12~15分間である.
b.ガラス化液による胚細胞内濃縮
ガラス化液への投入により,平衡液との浸透圧差を利用して細胞内を脱水し,凍結保護物質の相対的濃度を濃縮させる.ガラス化液1およびガラス化液2で十分なピペッティングを繰り返し洗浄する.脱水による胚収縮を確認できれば完了となり,処理時間は約60~90秒間である.
c.Cryotop®への導入および液体窒素投入による超急速冷却および低温保存
胚をCryotop®へ置き,液体窒素中へ直接投入する.超急速冷却により氷晶形成温度域の暴露時間を短縮できる.液体窒素濃度(-196℃)下では,胚構成分子が運動エネルギーを失い不動化して,半永久的に保存できる.
d.超急速加温による融解
凍結細胞の加温中は,脱ガラス化により細胞破壊されやすいので,冷却時よりもさらに急速加温が必要となる.Cryotop®法では,37℃融解液で直接加温することで,細胞内氷晶形成による物理的損傷を防止する.融解後,胚細胞内に残存する凍結保護物質を溶液の浸透圧差による拡散作用を利用して徐々に希釈除去する.
5)胚移植・黄体補充
ポイント
- 胚移植には,新鮮胚移植と凍結融解胚移植,分割期胚移植と胚盤胞移植がある.
- 凍結融解胚移植には,自然周期とホルモン調整周期がある.
- 胚移植は,超音波下に経頸管的に行われる場合が多い.
- 移植胚数は「生殖補助医療における多胎妊娠防止に関する見解」に則り,原則1個である.
①胚移植とは
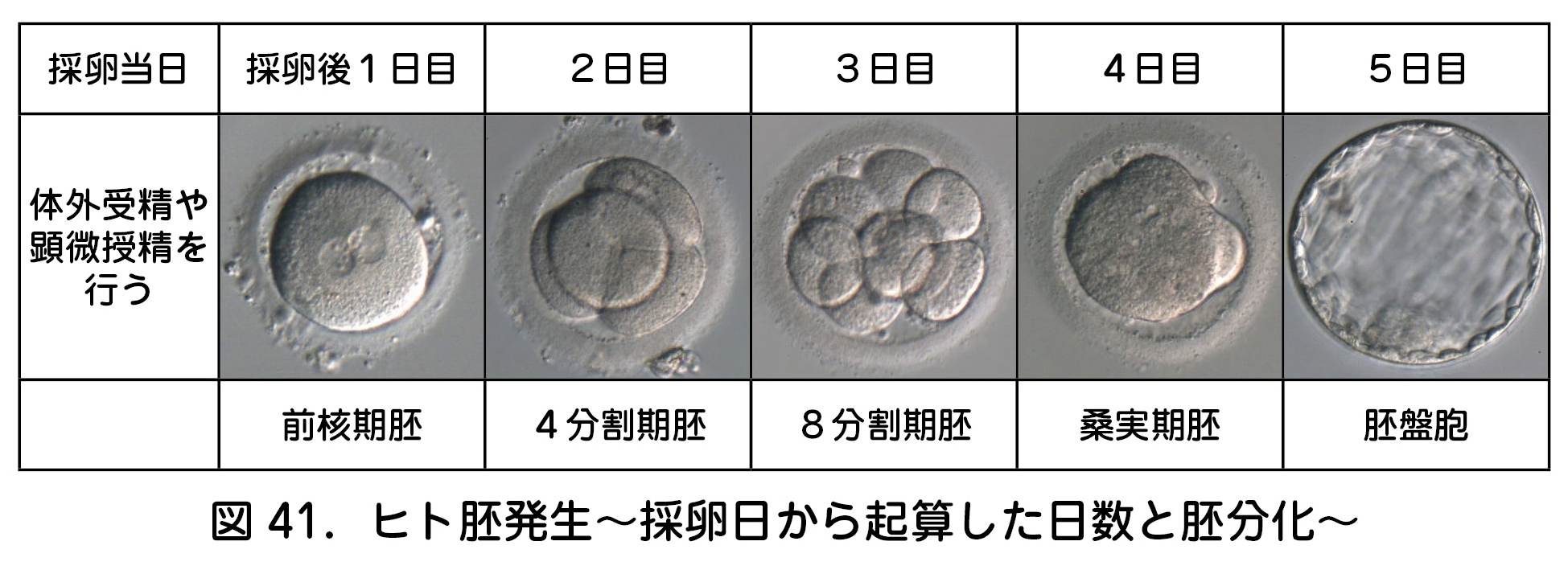
胚移植(ET:embryo transfer)とは,体外で受精させた胚を子宮腔内へ届ける操作を指す.どの段階の胚(図41)でも移植は可能であるが,分割期胚(初期胚)や胚盤胞(胞胚)で移植されることが一般的である.胚盤胞移植では,胚盤胞まで到達しない発育停止胚が移植対象から除かれるため,胚移植当たりの妊娠率は分割期胚移植より胚盤胞移植の方が高い.
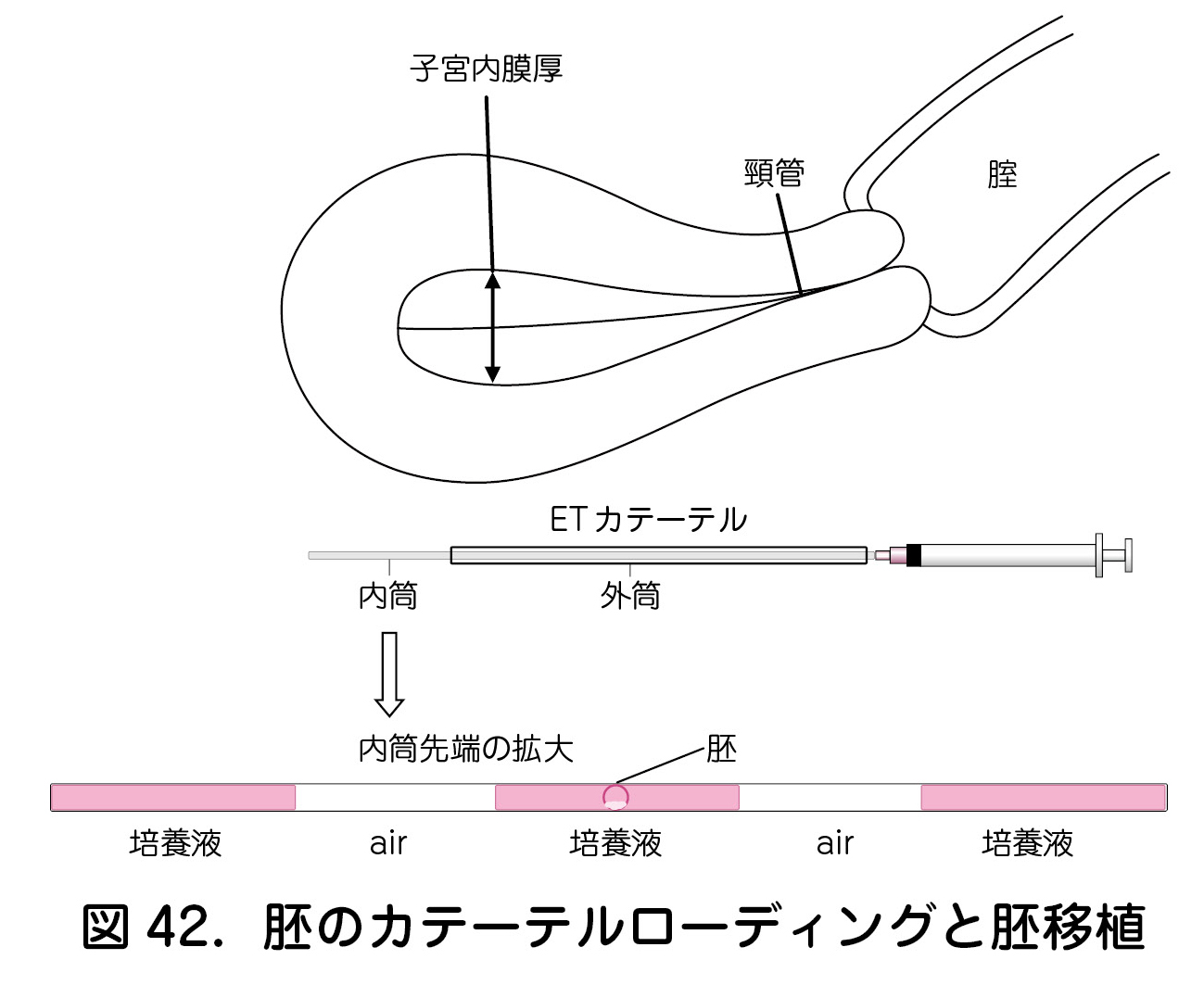
②胚移植の手技
胚は少量の培養液とともに子宮内腔へ移植される(図42).胚を子宮のよい位置に移植するために,超音波でカテーテルの先端を確認しながら実施する.超音波は,経腹あるいは経腟で実施する.胚移植に先立ち,腟内は生理食塩水で洗浄し,頸管粘液を取り除く.多胎妊娠回避のために,移植胚数は原則1個(SET:single embryo transfer)であるが,35歳以上あるいは2回の胚移植で連続して妊娠が成立しなかった反復不成功の場合には,2胚移植(DET:double embryo transfer)が許容される.胚移植にあたり透明帯の一部あるいは全体を菲薄化あるいは除去する処置を孵化補助法(AHA:assisted hatching)という.保険適用であり,症例に応じて施行される.AHAには,マイクロピペットなどによる機械的方法,タンパク質分解酵素などによる化学的方法,レーザー法があるが,近年は低侵襲であるレーザー法が主流である.胚移植時の培養液の選択肢として,高濃度のヒアルロン酸を含む培養液の使用がある.保険適用であり症例に応じて採用される.
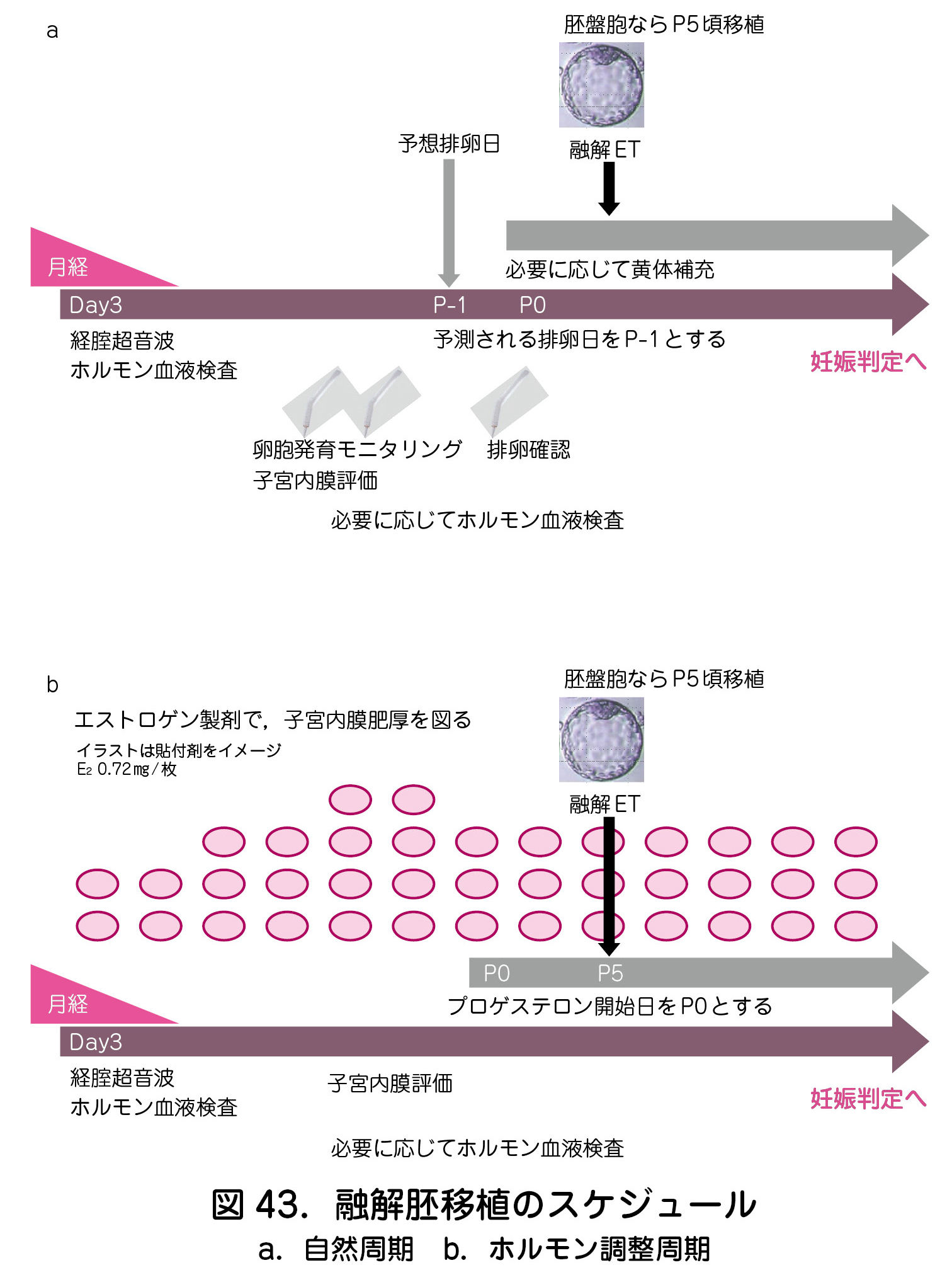
③胚移植のスケジュール
新鮮胚移植では,分割期胚移植なら採卵後2~3日目で,胚盤胞移植なら採卵後5~6日目で行う.凍結融解胚移植では,自然周期とホルモン調整周期がある.自然周期(図43a)では,排卵日を基準に,移植する胚のステージに合わせて胚移植日が決定される.ホルモン調整周期(図43b)では,エストロゲン製剤で子宮内膜を肥厚させ,子宮内膜厚が7~8mm以上になったことを確認後に黄体ホルモン製剤の投与を開始する.黄体ホルモン投与開始日を0日目として,分割期胚なら2~3日目で,胚盤胞なら5~6日目で胚移植を行う.
④反復不成功への対応
胚移植反復不成功などに対して追加的に実施される場合がある,保険適用のある処置として,アシステッドハッチング(AH:assisted hatching)と,高濃度ヒアルロン酸含有培養液がある.AHは,移植前の胚の透明体に切り込みを入れる補助孵化のことで,高濃度ヒアルロン酸含有培養液は,付着性化合物として胚移植時の培養液に添加することで,どちらもそれにより妊娠率・出産率の向上を期待する対応である.また,保険適用以外で,保険医療と併せて実施可能な自由診療である先進医療が存在する.
ヒト子宮内膜には,胚受容能を有する着床の窓(WOI:windows of implantation)と呼ばれる期間が存在し,一般的にWOIは月経周期の19~21日頃の分泌期中期である.しかしWOIには個人差が存在するため,反復不成功症例のWOIを調べることを目的として,子宮内膜受容能検査(ERA:endometrial receptivity analysis)や子宮内膜受容期検査(ERPeak)が存在する.
また,子宮内細菌叢が着床に関与する可能性から,子宮の細菌環境が着床に最適な状態であるかどうかを判定することを目的として行われる検査として,子宮内膜マイクロバイオーム検査(EMMA:endometrial microbiome metagenomic analysis)や,子宮内フローラ検査などが選択可能である.さらに,子宮内膜への胚着床に向けたシグナル発出を目指し,胚移植に先立ち胚培養液を子宮内に注入するSEET(stimulation of endometrium embryo transfer)法や,子宮内膜に小さなキズをつけ生化学物質の分泌を促す子宮内膜スクラッチなどが存在する.
6)未受精卵子の凍結
ポイント
- 採卵時年齢は36歳未満が望ましく,その利用は45歳以上においては推奨できない.
- 年齢などの患者背景により大きく異なるが,将来児を出産するためには,一般的に10~15個程度の卵子を凍結保存することが望ましい.
- 卵巣刺激方法は,社会的適応の卵子凍結の場合はPPOS法,GnRHアンタゴニスト法が一般的な選択肢となる.
①社会的適応に対する学会声明
卵子凍結は「医学的適応」と「社会的適応」に大別される.加齢などの要因により性腺機能の低下を来す可能性を懸念する場合には,「社会的適応」として本人の同意に基づき未受精卵子を凍結保存することができる.日本生殖医学会倫理委員会のガイドラインでは,凍結保存の対象者は成人女性で,未受精卵子の採取時の年齢は36歳未満が望ましいとされる1).また,凍結保存した未受精卵子の使用年齢に関して45歳以上は推奨できないと記載している2).加えて,凍結卵子の保管は長期間になることが予想されるため,十分な情報提供(表15)や保管管理体制の構築を行った上で実施すること,としている.
一方で,日本産科婦人科学会生殖・内分泌委員会の声明では,社会的卵子凍結は医療の範疇に入らないため,基本的に実施を推奨しない,としている3).やむを得ず治療を実施する場合には,患者が妊娠・出産に関する医学的リスクなどを理解した上で,ART登録施設において実施することが望ましいとされる.

②挙児を得るために必要な卵子個数
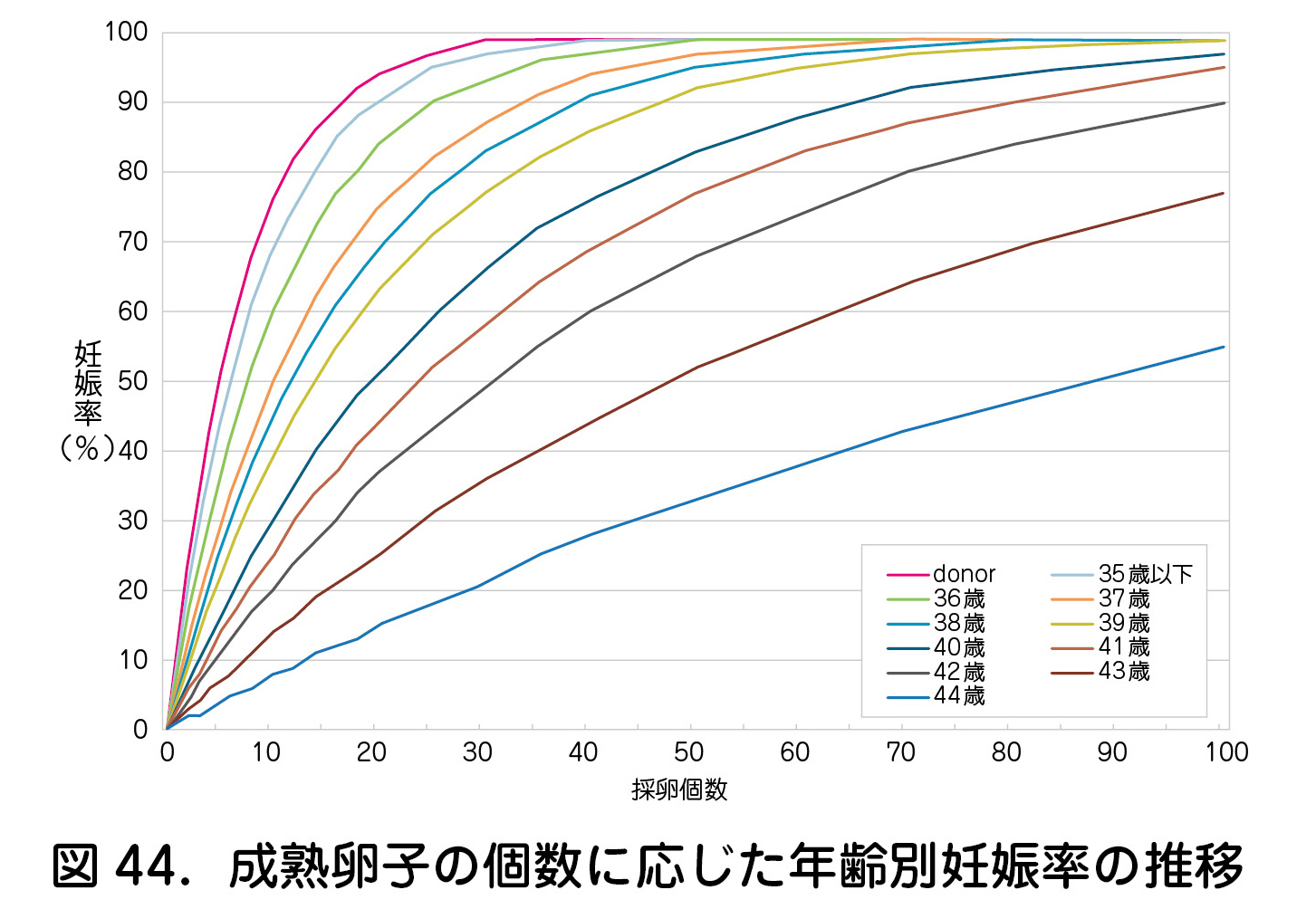
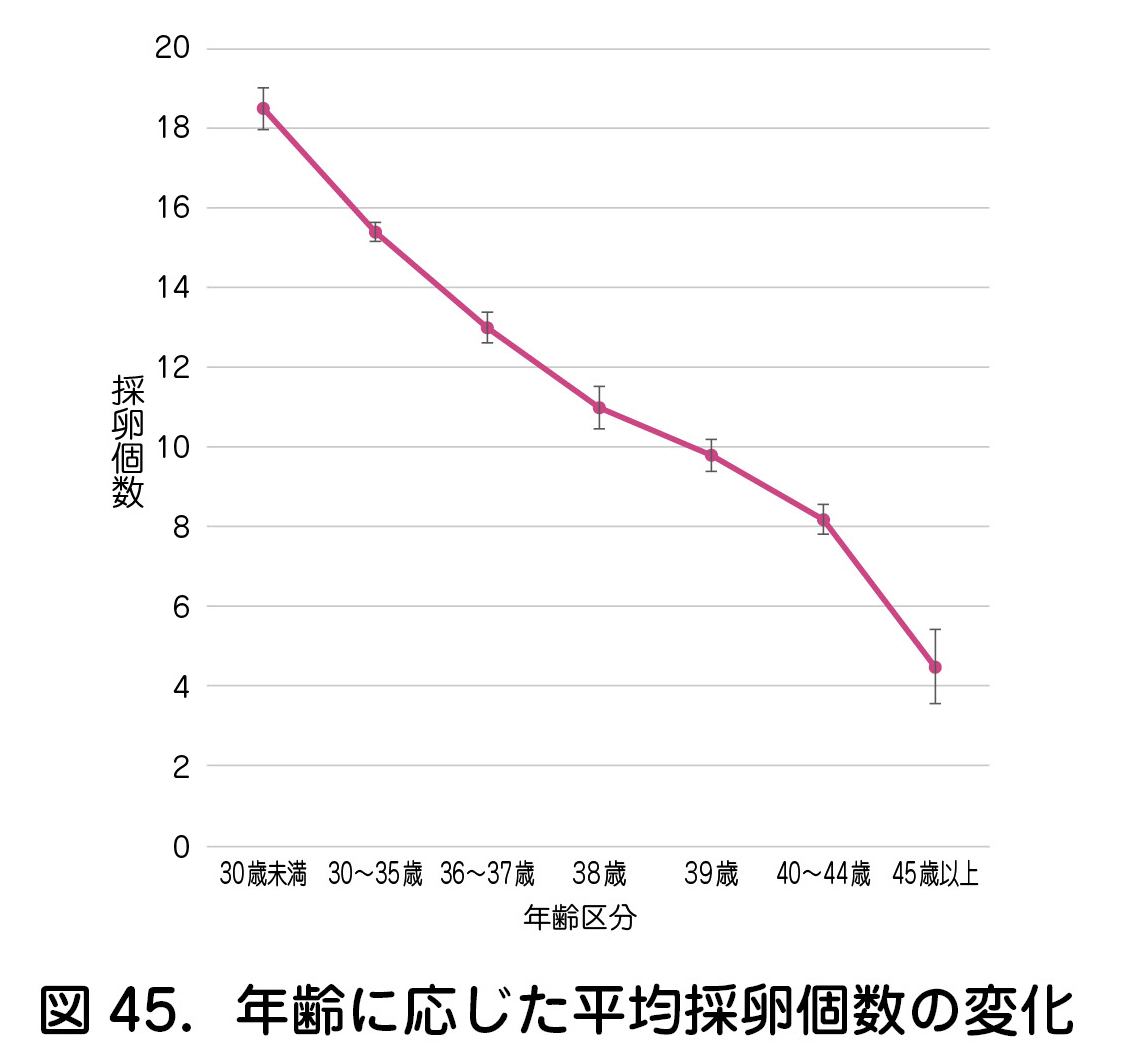
では,将来挙児を獲得するために必要な凍結卵子個数はどの程度だろうか.累積妊娠率は採卵個数がある程度多い場合に一定のプラトーに達するため,高い確率の挙児を希望する場合にはできる限り短期間に適切な卵巣刺激を実施し,十分な個数の卵子を凍結することが肝要である(図44)4).また,35歳未満の症例では,凍結卵子数の増加に伴った累積妊娠率の上昇がCoboらによって報告されている5).以上の点から,年齢や状況によって差はあるものの,卵巣過剰刺激症候群(OHSS:ovarian hyperstimulation syndrome)も考慮し,一般的には10~15個程度を目標としたい.ただし,年齢の上昇に伴って挙児獲得に必要な卵子個数が増える反面,1周期で獲得できる採卵個数が低下する点は注意を要する(図45)6).
③卵巣刺激方法
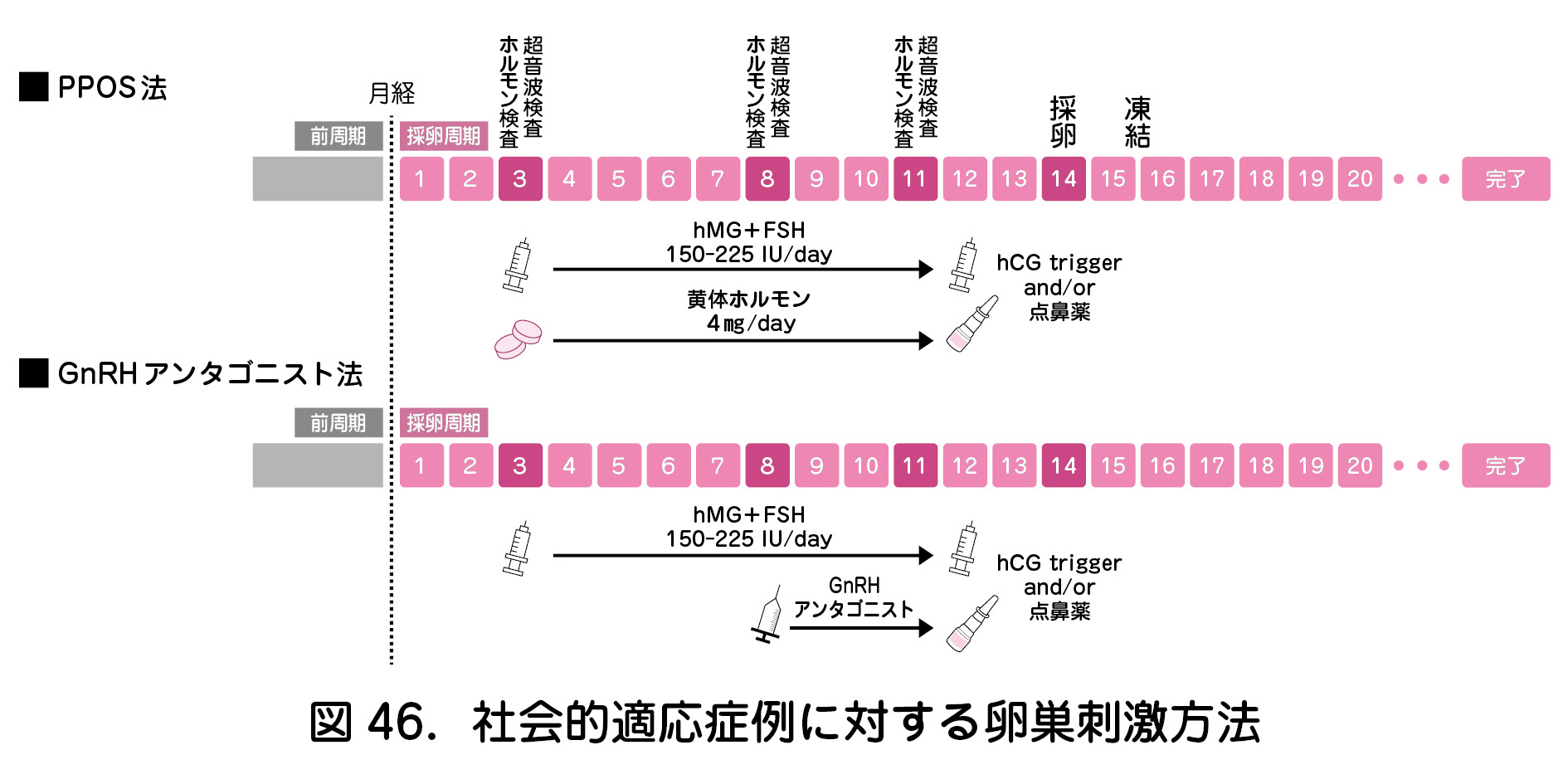
医学的適応の卵子凍結の場合,原疾患治療の開始までに緊急性を要する場合もあり,「ランダムスタート法」や「Duostim法」などが卵巣刺激方法として利用される.社会的適応の卵子凍結に対しては,主に以下の選択肢が挙げられる.
a.PPOS(Progestin-primed ovarian stimulation)法(図46)
月経周期3日目より黄体ホルモン(内服)とゴナドトロピン(注射)を併用することにより,premature LHサージを適切に抑制しながら卵胞発育を促す卵巣刺激が可能となった.OHSSも軽度で済む場合が多い.
b.GnRHアンタゴニスト法(図46)
PPOS法と同様に,月経周期3日目よりゴナドトロピンを投与することで卵胞発育を促し,排卵抑制としてGnRHアンタゴニストが用いられる.高反応型の患者に対してはOHSSの軽減のためにトリガーとしてGnRH アゴニストも使用可能で,刺激周期が短いことから利用が推奨される.
文献
- 1)日本生殖医学会.ガイドライン倫理委員会報告「未受精卵子および卵巣組織の凍結・保存に関するガイドラ イン」.2018 年3 月30 日発行(http://www.jsrm.or.jp/guideline-statem/guideline_2018_01.html)(2023 年3 月アクセス)
- 2)日本生殖医学会.ガイドライン倫理委員会報告「未受精卵子および卵巣組織の凍結・保存に関するガイドラ イン」.2013 年11 月15 日発行(http://www.jsrm.or.jp/guideline-statem/guideline_2013_01.html)(2023 年3 月アクセス)
- 3)生殖・内分泌委員会.生殖医療リスクマネージメントシステム構築に関する小委員会.日本産科婦人科学会 雑誌.67(6):1493-1511,2015
- 4)Goldman RH, et al. Predicting the likelihood of live birth for elective oocyte cryopreservation: a counseling tool for physicians and patients. Hum Reprod. 32: 853-859, 2017
- 5)Cobo A, et al. Is vitrification of oocytes useful for fertility preservation for age-related fertility decline and in cancer patients?. Fertil Steril. 99: 1485-1495, 2013
- 6)Tan TY, et al. Female ageing and reproductive outcome in assisted reproduction cycles. Singapore Med J. 55: 305-309, 2014

