(4)卵巣がんに対する新規標的治療開発(馬淵誠士)
1 )分子標的治療の意義
2006 年に,プラチナ・タキサン併用療法に第三の抗癌剤を追加しても卵巣癌の予後が改善されないことが報告され,分子標的薬の臨床導入へ期待が高まった.2011年には,プラチナ・タキサン併用療法にベバシズマブを追加すると,さらなる延命効果が得られることが証明され,他の分子標的薬についても臨床開発が精力的に進められている.
2 )ベバシズマブ(抗VEGF-A 中和抗体)
ベバシズマブは微小血管の退縮・血管新生抑制・腫瘍血管の正常化を介して腫瘍を退縮させる.また,血管透過性の低下を介して胸腹水の産生を抑制しQOL の改善にも寄与する.
本邦では,初回化学療法(プラチナ・タキサンとの併用+維持化学療法)および再発癌治療(化学療法との併用)に用いられるが,投与にあたっては,特有の有害事象(消化管穿孔・高血圧・蛋白尿・出血・血栓塞栓症)に注意が必要である.
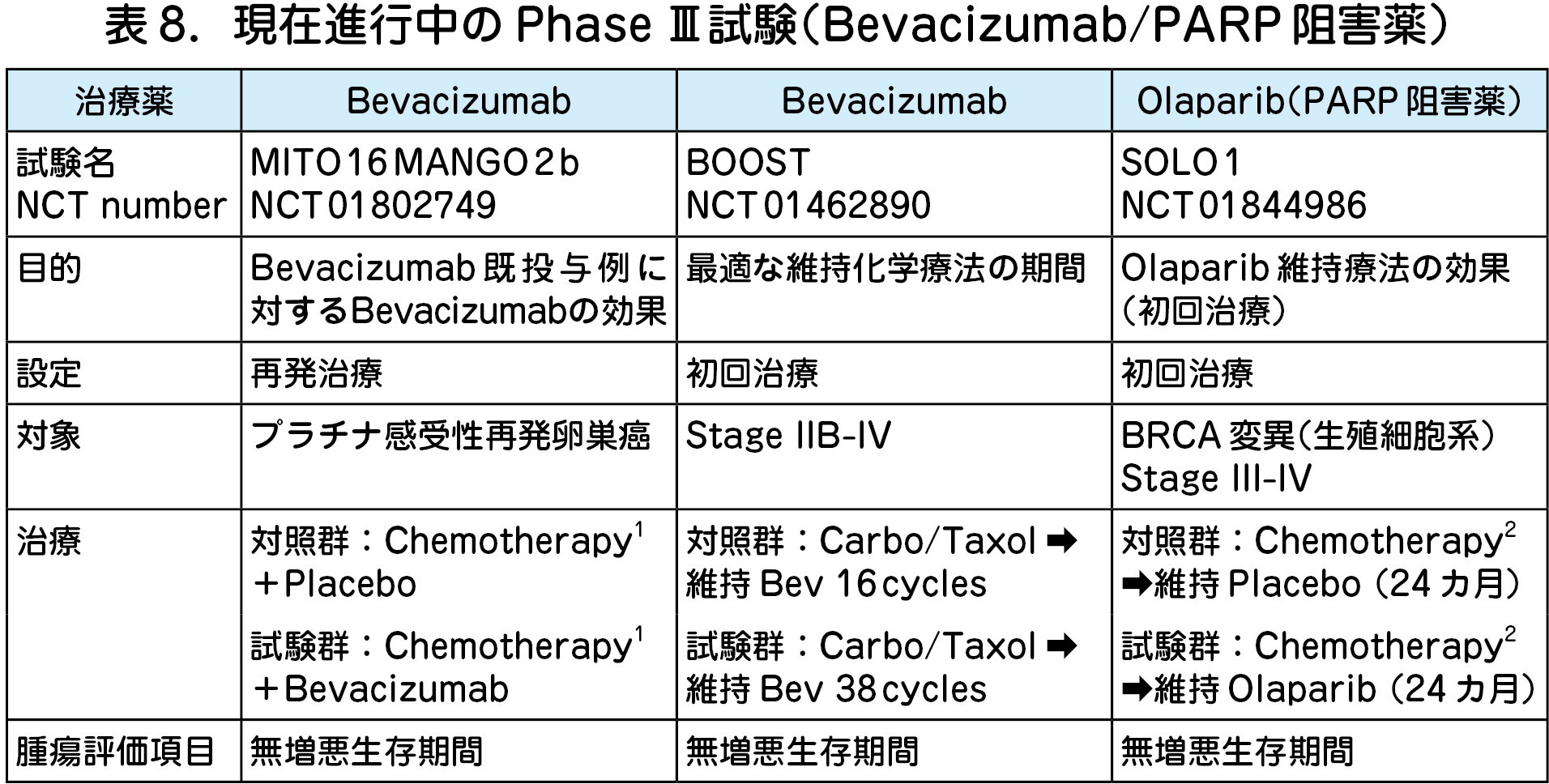
現在進行中の臨床試験を以下に示す(表8).①ベバシズマブ維持投与期間,②ベバシズマブ治療中増悪例における継続投与(Bevacizumab beyond PD)の是非が明らかとなろう.
3 )PARP 阻害薬
① PARP およびPARP 阻害薬
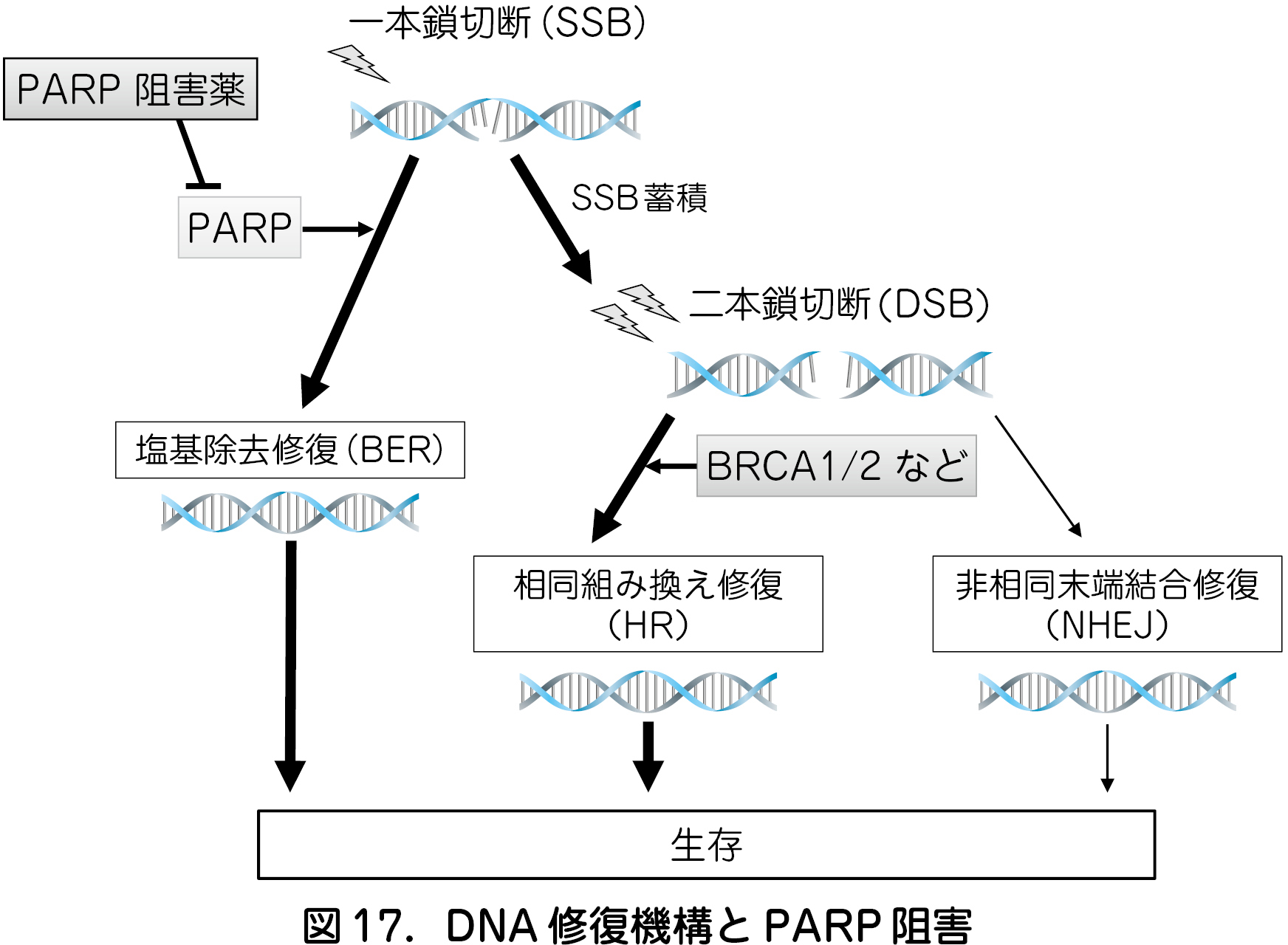
DNA 損傷には複数の修復機転が関与し,Poly(ADP-ribose)polymerase(PARP)は一本鎖DNA 切断(SSB:Single-Strand Break)の塩基除去修復(BER:Base Excision Repair)に関与する(図17).PARP を阻害するとSSB の修復が持続的に阻害され,SSB は二本鎖DNA 切断(DSB)へと変化する.DSB は相同組み換え(HR:Homologous Recombination)が正常に機能すれば修復されるが,BRCA 1 / 2 などのHR 関連遺伝子・蛋白に異常が生じた状態(HRD:HR Deficiency)では,DSB 修復は,より不確実な非相同末端結合(NHEJ:Non-homologous end jointing)に依存するため,一定の割合で修復に失敗し,「合成致死」とよばれる細胞死が誘導される(図17).PARP 阻害薬はHRD の状態にある癌に対して有効と考えられるが,卵巣癌においては,BRCA1 / 2 変異だけでなく,他の原因によるHRD も高頻度に観察されており,PARP 阻害薬の効果が期待されている.PARP 阻害薬は経口薬であり,また副作用が比較的軽微である.2014 年の米国での承認に引き続き本邦でも臨床導入が始まっている.
② PARP 阻害薬の臨床エビデンス
a.PARP 阻害薬の単剤・併用治療
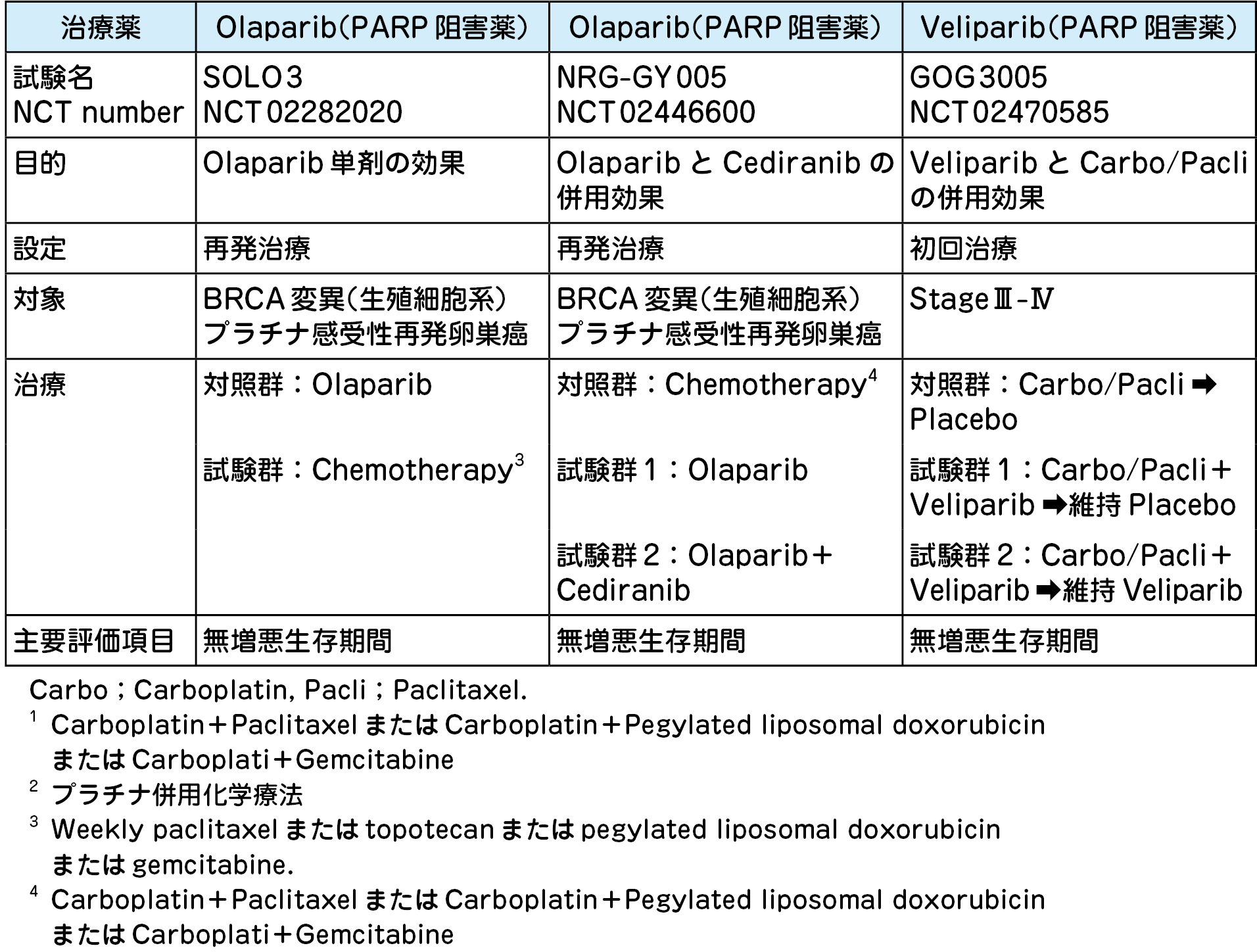
BRCA 1 / 2 変異を有し,3 レジメン以上の治療歴を有する再発卵巣癌を対象とした第Ⅱ相試験にて,オラパリブは奏効率:31~34%(プラチナ耐性癌でも30%),奏効期間中央値:7 . 5~7 . 9 カ月,と良好な結果を示した.現在,① PARP 阻害薬単剤の効果,② PARP 阻害薬と他の分子標的薬または殺細胞性抗癌剤との併用療法の有効性を評価中である(表8)
b.PARP 阻害薬の維持療法
再発卵巣癌を対象に,プラチナ併用化学療法後の維持療法の有効性を検討した第Ⅲ相試験の結果が報告されている.BRCA 変異陽性症例のみを対象としたSOLO-2試験では,維持療法としてのオラパリブはPlacebo に比して無増悪生存期間を1 年以上も延長した(19 . 1 カ月vs 5 . 5 カ月;p<0 . 0001).興味深いことに,BRCA 変異およびHR status 別にニラパリブ維持療法の効果を検証したNOVA 試験では,ニラパリブはBRCA 変異やHRD の有無にかかわらず無増悪生存期間を延長した.この結果は,PARP 阻害薬による維持療法の有効性だけでなく,BRCA 変異やHRD による薬効予測の限界をも示唆しており,早期にバイオマーカーを開発する必要がある.現在,初回化学療法後の維持療法の設定で,PARP 阻害薬の有効性を検討するSOLO-1試験が進行中であり(表8)結果が待たれる.
4 )臨床開発段階にある新規薬剤
卵巣癌で過剰発現している分子を標的としたPI3K/AKT/mTOR 阻害薬,葉酸受容体阻害薬,抗MUC16抗体(MUC はCA125の原料),また腫瘍免疫に関わる蛋白を標的とした免疫チェックポイント阻害薬などの臨床開発が進行中である.中でも,PI3K/AKT/mTOR 阻害薬および免疫チェックポイント阻害薬については,本邦から発信された前臨床研究の成果に基づいて臨床開発が進められており,Positive な結果が期待される.
5 )おわりに
四半世紀にわたる基礎研究・橋渡し研究の中から,卵巣癌の治療標的分子候補が多数見いだされている.現在,阻害薬の臨床開発が精力的に進められているが,未解決の課題も多い.例えば,分子標的薬の至適投与量の決定方法や抗腫瘍効果の評価方法は殺細胞性抗癌剤のそれとは異なる可能性があるが,その方法は確立されていない.また,恩恵を受ける可能性が高い患者集団を選別するためのバイオマーカーや,これを測定するコンパニオン診断薬の開発も不十分である.臨床医と研究医の協力により,これらの課題が解決され,分子標的治療が真のプレシジョンメディスンとして定着することを期待したい.

