(1)子宮頸癌・子宮体癌に対する手術
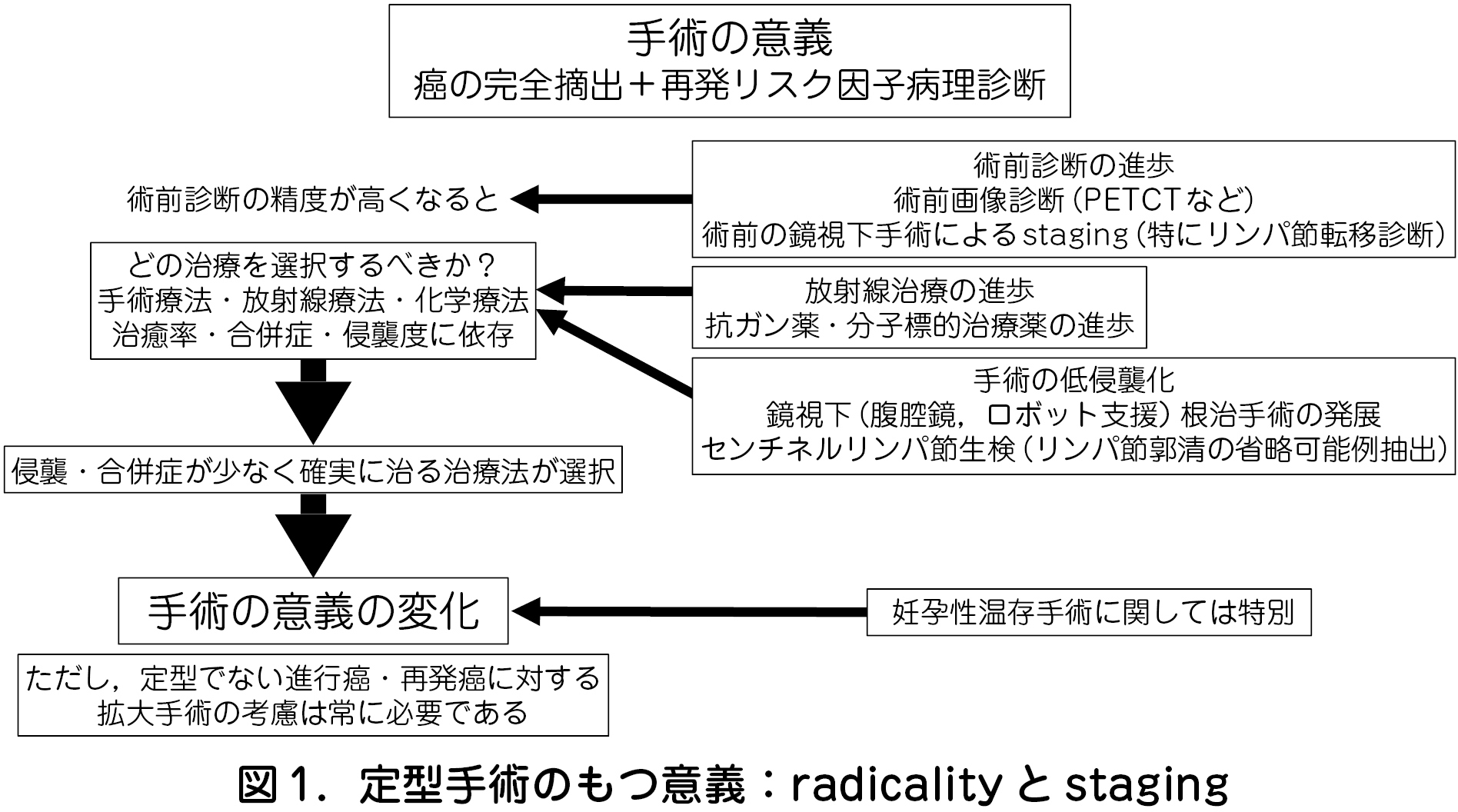
1 )定型手術のもつ意義:radicality とstaging(三上幹男)
手術の意義は「癌の完全摘出」と「再発リスク因子の病理学的診断」の二つである.この考え方が将来「画像診断の進歩」と「手術の低侵襲化」というキーワードで変化していく(図1).
・子宮頸癌
術後病理診断で再発リスク因子があれば同時化学放射線療法を追加するのが一般的である.将来は高度に発達した最新の画像診断により再発リスク因子が術前に正確に評価され,若年者(卵巣機能を温存する必要がある)で術後治療不要と予測される例に対してのみ鏡視下根治術が行われる.再発リスク因子をもつと予想される例は初めから同時化学放射線療法(新たな分子標的薬の併用も?)が行われるであろう.また一方で婦人科に独特な妊孕性温存手術は別の発展が期待される.
・子宮体癌
体癌は,手術で原発巣を摘出することが第1 選択であり,リンパ節郭清については再発低リスクであれば省略,中・高リスクであれば傍大動脈節まで行うことが基本である.将来は,術前画像診断によるリンパ節転移の診断,センチネルリンパ節生検によるリンパ節郭清の省略可能例の抽出が行われ,すべての手術は鏡視下で行うことが前提となる.
2 )根治性を追求する手術(永瀬 智)
分子標的治療薬の導入や化学療法・放射線療法の進歩に伴い,子宮頸癌・子宮体癌に対して他臓器合併切除が必要となる症例は限定されている.しかし,特に子宮頸癌の照射野内再発症例では完全切除によってのみ長期生存が期待されることから,膀胱,尿管,直腸などを合併切除する骨盤除臓術(PE:Pelvic Exenteration)の重要性は失われてはいない.
・骨盤内に再発した子宮頸癌の治療フローチャートを図2 に示す.前治療で放射線治療を受けていない場合は同時化学放射線療法により根治が期待できるが,組織型が腺癌の場合や再発治療後も腫瘍が残存している場合ではPE も選択肢となり得る.
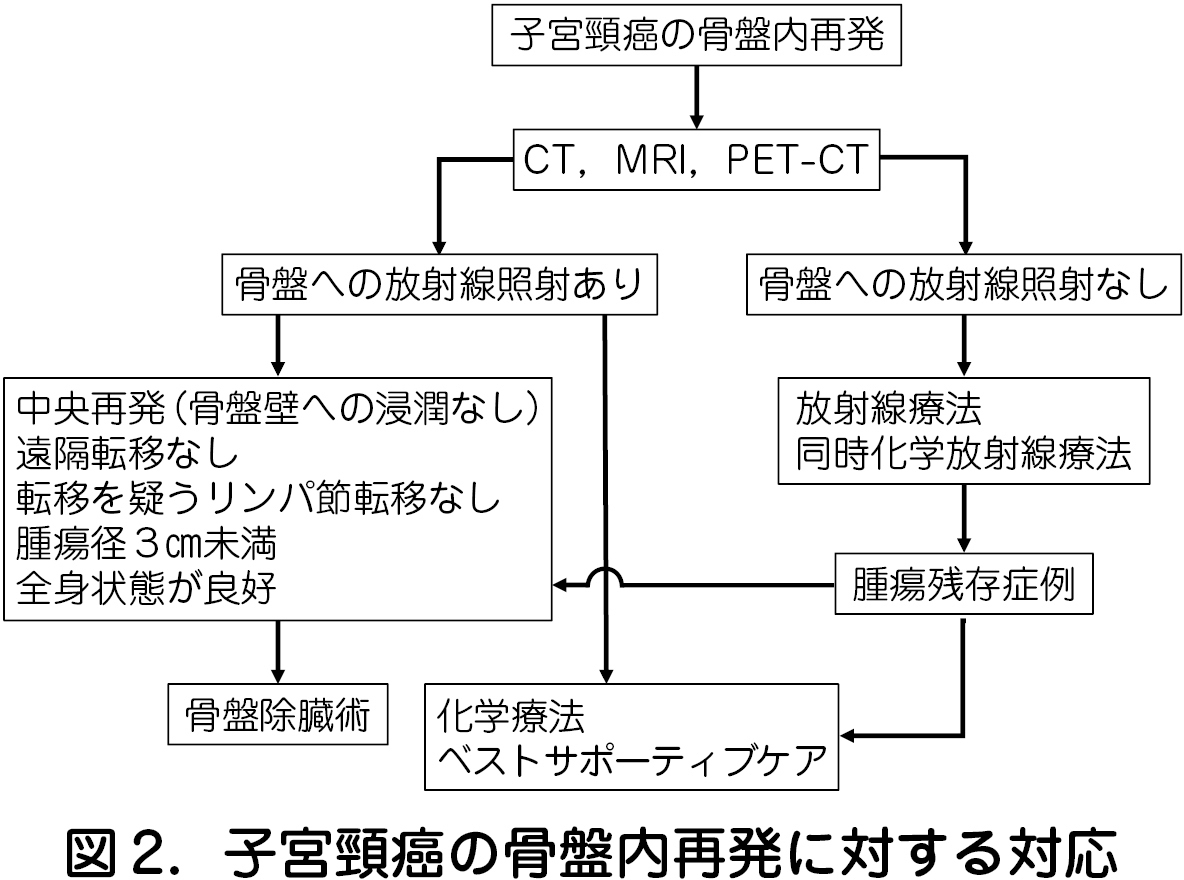
・PE 後に良好な予後が期待できる因子は,骨盤内中央再発で骨盤壁への浸潤がなく完全切除が可能,転移を疑うリンパ節腫大がないこと,腫瘍径が3㎝未満,全身状態が良好,である.治療前の評価でこれらすべてを満たせば,PE のよい適応となるが,PE には尿路変更や人工肛門造設を伴うため,各診療科との連携,術後のQOL について患者と家族へ十分なインフォームドコンセントやカウンセリングが不可欠である.
・内腸骨血管系,内閉鎖筋,尾骨筋,腸骨尾骨筋および恥骨尾骨筋を含め,PE より広範囲に切除するlaterally extended endopelvic resection(LEER)により,骨盤壁に達する側方再発でも完全切除が可能となり,予後改善も期待されるが普及が課題である.
・鏡視下手術のもつ拡大視野効果,高い深部到達能はPE においても有効であり,合併症発生率,周術期死亡率低下に寄与し得る.既に腹腔鏡下手術による側方再発の完全切除症例の報告があり,今後は腹腔鏡下やロボット支援下手術の利点を生かし根治性を追求した手術がさらに発展するものと思われる.
3 ) 子宮を傷つけない手術:子宮頸部上皮内腫瘍に対するレザフィリンとPD レーザーを用いた光線力学療法(坂本 優)
PDT(PDT:Photo Dynamic Therapy)は,子宮頸部を切除しないで光化学作用により子宮頸部病変を治療するため,CIN 3 の子宮温存療法として,円錐切除術よりも妊孕性温存能が高い治療法であると考えられる.従来のPHOTOFRIN® を用いたPDT(P-PDT)も奏効率が97%と高く,早産などの産科的リスクは低かったが,光過敏症という副作用が強く入院期間も長いため,標準治療には至っていなかった.しかしながら,血中半減期がPHOTOFRIN® の約半分と代謝が早く光過敏症がほとんどみられないLASERPHYRIN® と半導体レーザー(PD レーザー)を用いたPDT(L-PDT)の安全性と有効性が徐々に医師主導第Ⅰ/Ⅱa 相臨床試験で示されている.
すなわち,L-PDT では,光過敏症がほとんどみられず,一時的な下腹部痛や発熱がみられるものの安全性に問題はなく,治療効果も期待できたことから,第Ⅰ相臨床試験開始後1 年で早期第Ⅱ相臨床試験に移行している.また,PD レーザーは病棟のワゴン上にも搭載可能なほど小型化したため,現行機のエキシマダイレーザーと比較しても値段が5 分の1 と安価になった.また,半導体レーザーであるため,メンテナンスが容易で維持費もかからないなど,ハード面のメリットも大きい.以上より,L-PDT は子宮頸部上皮内腫瘍に対する次世代のPDT として定着することが期待される.
4 )機能温存手術と鏡視下手術(小林裕明)
手術療法の基本原則は,病巣にマージン(がん細胞が存在しないと想定される“のりしろ”)をつけて切除し,転移しやすい離れた部位(リンパ節など)を合併切除することであるが,近年,婦人科悪性腫瘍に対して再発率を上げない範囲での縮小手術が広まっている.本稿ではセンチネルノード(SN:Sentinel Node)・ナビゲーションサージャリー(SNNS),鏡視下手術(腹腔鏡・ロボット手術),妊孕能温存手術に関して概説する.
①センチネルノード・ナビゲーションサージャリー(SNNS)
センチネルリンパ節(SN)とはがん原発巣からのリンパ流が最初に流れこむ1 次リンパ節のことである.SN に転移がなければそれより下流のリンパ節には転移がないとするのが“センチネルリンパ節理論”であり,術中にSN に転移がないことを確認できれば系統的所属リンパ節郭清を省略するのがSNNS である.SNNS を行うにはセンチネルリンパ節理論が成り立ち,かつ病巣周囲へのトレーサー注入が容易な癌腫が好ましい.子宮頸癌は左右の骨盤リンパ節(PLN:Pelvic lymph Node)を経て傍大動脈リンパ節(PAN:paraaortic lymph node)へと拡がるというリンパ行性の転移経路が分かっているうえ,ⅠB 1 期までの患者のうち約9 割にはPLN 転移すらないことからSNNS に適した腫瘍と言える.すなわち,SNNS を行うことにより,大多数のSN陰性患者で系統的リンパ節郭清を省略でき,下肢リンパ浮腫・リンパ囊胞のみならず,手術時間,出血量,腸閉塞や神経損傷の発生リスクを減らした低侵襲手術が可能となる.さらに,少数のSN に対して集中した病理検索を行う(2㎜間隔の連続切片で診断を行う)ため,系統的リンパ節郭清で得られた数十個のリンパ節を一通り病理検索するよりもリンパ節転移の診断精度は高い.
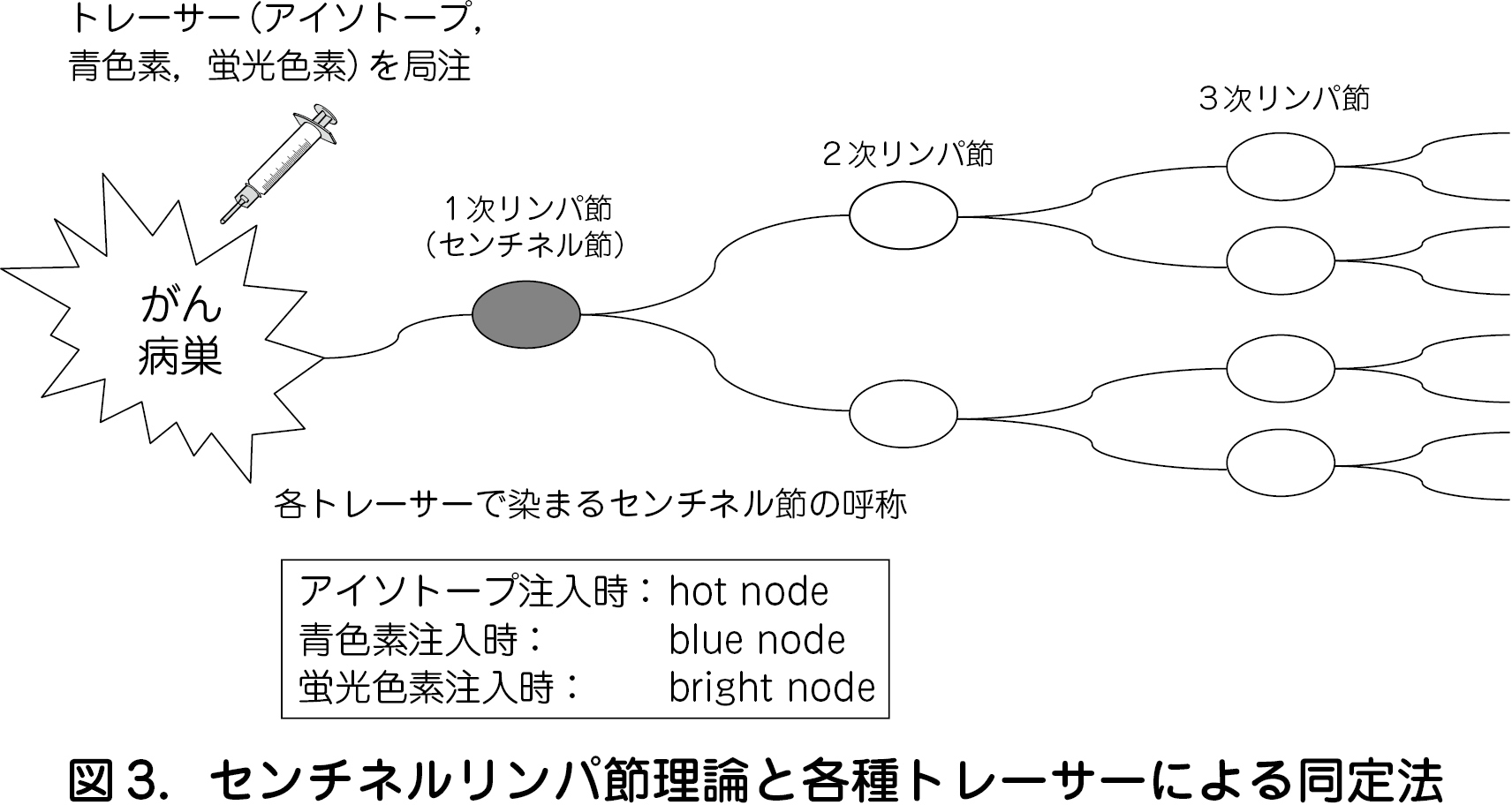
SNNS では各種トレーサーを用いてSN を同定する(図3).すなわち,RI 法では99 mTc を標識したフィチン酸,スズコロイドを,色素法ではインジゴカルミン,パテントブルーが用いられる.RI 法は施行できる施設が限定されるものの,トレーサーの粒子が大きく長時間リンパ節にとどまるため,リンフォシンチグラフィで推定したhot node の切除が容易である.色素は直視下に確認できるものの,粒子が小さく注入後数分でリンパ路を流れてしまうため,SN を見逃し,下流のリンパ節をSN と誤認する可能性がある.蛍光法はインドシアニングリーン(ICG)が赤外光照射で励起され蛍光を発する特徴を利用したSN 同定法である.わずかなICG が残留したSN でも近赤外線蛍光カメラで描出できるため,青色素よりSN 同定率は高い.RI が使用できない施設にとって魅力的なトレーサーであり,一次リンパ節への停留性に優れた高分子化したICG が開発されればさらに有用性が高まる.
自験例での検討(n>200)でも,PLN 郭清を省略できた症例に術後下肢リンパ浮腫の発生は無かった.現在,SNNS の保険収載に向けて活動中である.
②鏡視下手術(腹腔鏡・NOTES・ロボット手術)
小さな術創で行う腹腔鏡手術は入院期間の短縮,術中出血量や術後腸閉塞の減少などの恩恵をもたらす.根治性を落とさなければ開腹術にとって代わるべきminimallyinvasive surgery(MIS)であり,子宮体癌に関してはⅠ期低リスク群が2014 年から保険収載(骨盤リンパ節郭清のみ許容),Ⅰ期中・高リスク群およびⅡ期が2017 年から先進医療認定(傍大動脈リンパ節郭清も許容)された.初期子宮頸癌に対しても2018年4 月から広汎子宮全摘(RH)が保険収載され,今後は機器の充実に伴い更なる適応拡大が期待される.
近年,体表面に創を作らない新たなMIS として, 生体の自然孔(口,肛門,腟,膀胱など)から軟性内視鏡を挿入し,管腔壁を経て体腔内手術を行う経管腔的内視鏡手術(NOTES:Natural Orifice Translumenal Endoscopic Surgery)が注目されている.婦人科でも経腟的ルートを用いて腹腔鏡手術操作を補助するHybrid NOTES の発展が望まれる.
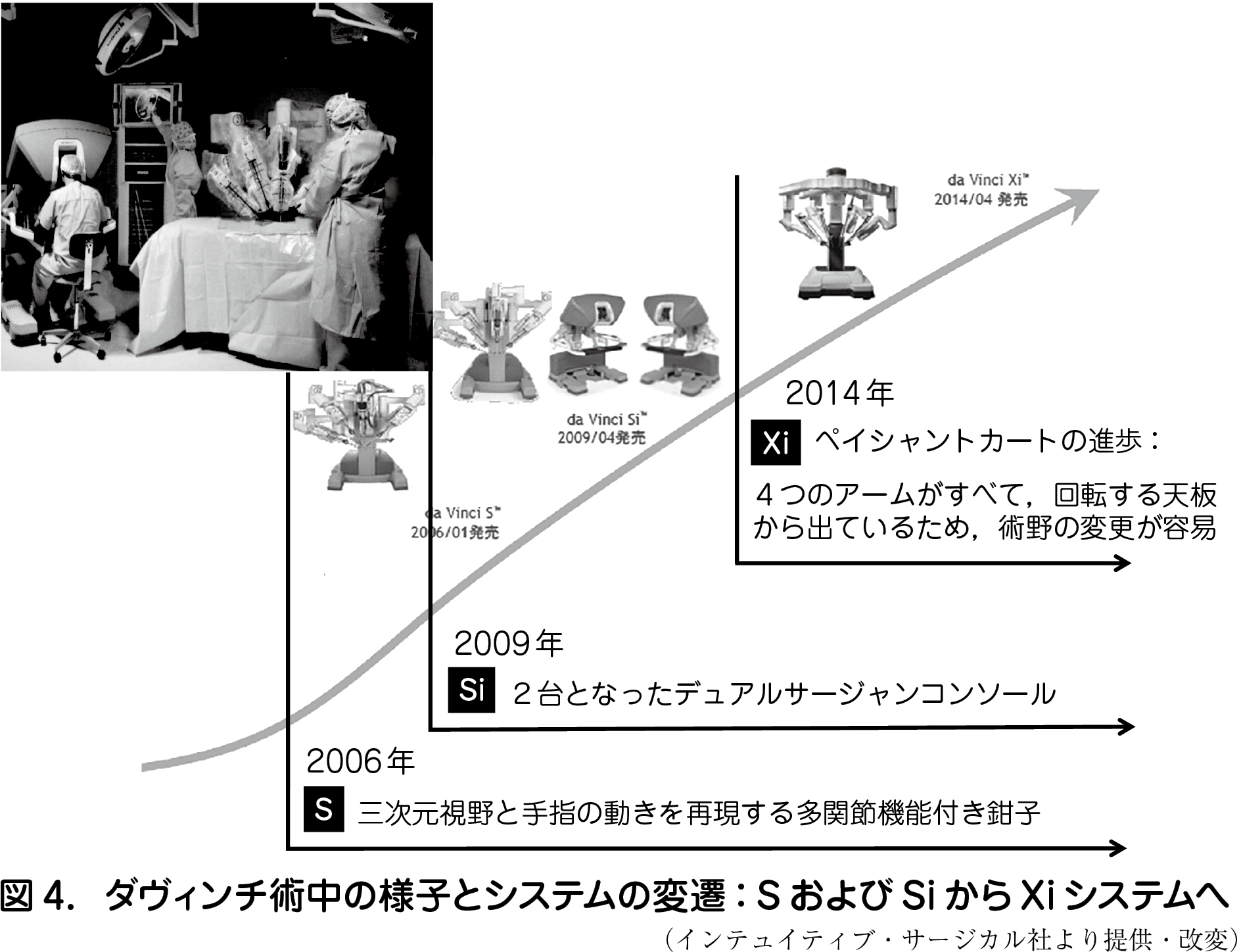
ロボット手術も普及が期待されるMIS である.高価であること,セッティングの煩雑さ,保険適応が限られていること,など欠点もあるが,低侵襲性に加えて巧緻性が患者に与える恩恵は多い.腹腔鏡はその熟達度によって術者によるクオリティギャップを生じやすいが,ダヴィンチシステム® では遠近感に優れた三次元拡大視野,手指の動きを忠実に再現する多関節機能を有する鉗子,手ぶれ防止機能などにより精細な手術手技が可能となったため,ロボット手術のラーニングカーブは非常に短い(図4).
婦人科癌では骨盤領域の手術のみならずPAN 郭清や大網切除などの上腹部操作を要することがあるが,最新機種では術野を180 度回転して操作を行うデュアルドッキングも可能である.婦人科癌に対するロボット手術は,初期子宮頸癌(先進医療)に加えて2018 年4 月から低リスク子宮体癌(保険収載)にも適応が拡大する.更なる手術システム・鉗子の進歩や他社製品の参入に伴うコストダウンも見込まれるが,安全かつ円滑なロボット手術の普及には関連学会による指導が不可欠となる.
ロボット手術の将来像としては,RH やPAN 郭清などの高難度治療を対象とするだけでなく,触覚を有する鉗子や単孔式ロボット鉗子をNOTES に応用する手術や,開腹で手が届かない骨盤深部の再発巣切除などにも適用される時代を迎えると思われる.
③妊孕能温存手術
本邦では晩婚・晩産化と子宮頸癌罹患の若年化により,妊孕性温存手術である広汎子宮頸部摘出術(RT:Radical Trachelectomy)の必要性が高まっているが,正確な病理診断と進行期診断のもと慎重に適用し,患者とその家族に対して十分なインフォームドコンセントを行うことが肝要である.RT は子宮頸部を周囲靱帯と腟壁も含めて広く切除後,腟管と子宮体部側を吻合して子宮を再建することで将来の妊娠を可能とする術式である(図5).
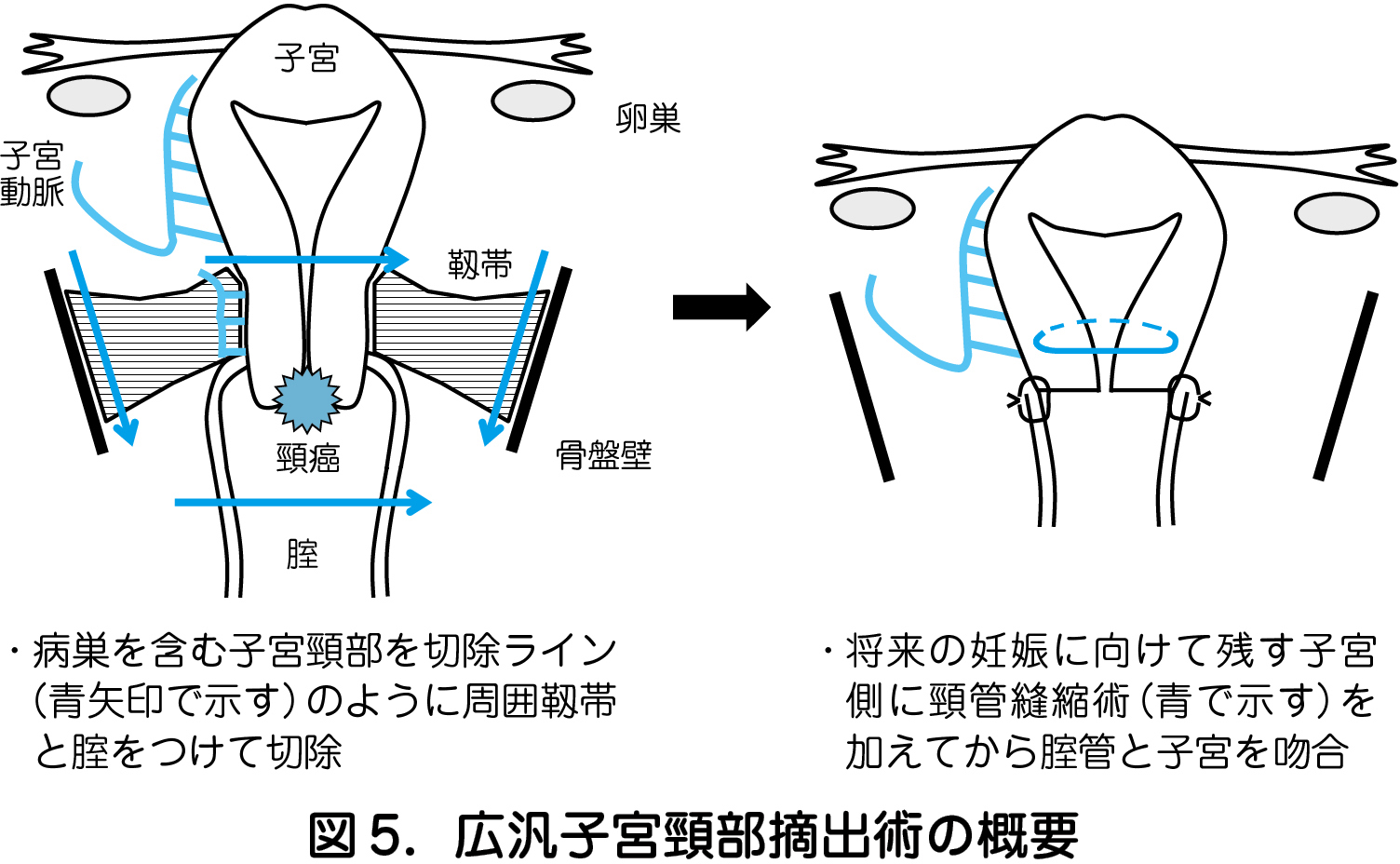
安全性向上のため,SNNS と頸管切断面の術中病理診断を併用した自験例の再発率は1 %以下であり,術後妊娠を試みた患者の30 %に妊娠が成立し,児心音が確認できた全例で生児を得ている.とはいえ,術前化学療法を組み合わせた適応拡大,術前・術中検査の精度向上,産科的アウトカムの改善など取り組むべき課題は多く,現時点では生殖,周産期,婦人科腫瘍の専門性を同時に有する施設で集学的に行われるべき試験的治療である.発展型RT として,ロボット支援下に行うRT と妊娠中に行うRT がある.前者では精緻な操作による機能温存と術後腹腔内癒着の低減により,自然妊娠率も向上する可能性が期待される.後者は強い挙児希望を持ちながらも,児の体外生存が可能な妊娠週数まで治療を待期できない症例に対し,児が子宮内にいるままRT を行うものである.自験例では再発なく生児が得られたものもあるが,術後子宮内胎児死亡が生じたものもある.今後は有効な抗腫瘍効果と胎児への安全性を兼ね備えたin utero 化学療法を進歩させ,体外生活可能な時期まで治療のうえ,帝王切開に引き続きRT を行う方がより現実的な将来像ではないかと思われる.

