(1)がん免疫療法(濵西潤三)
〈キーワード〉
免疫チェックポイント,PD-1,PD-L1,CTLA-4,がん免疫療法
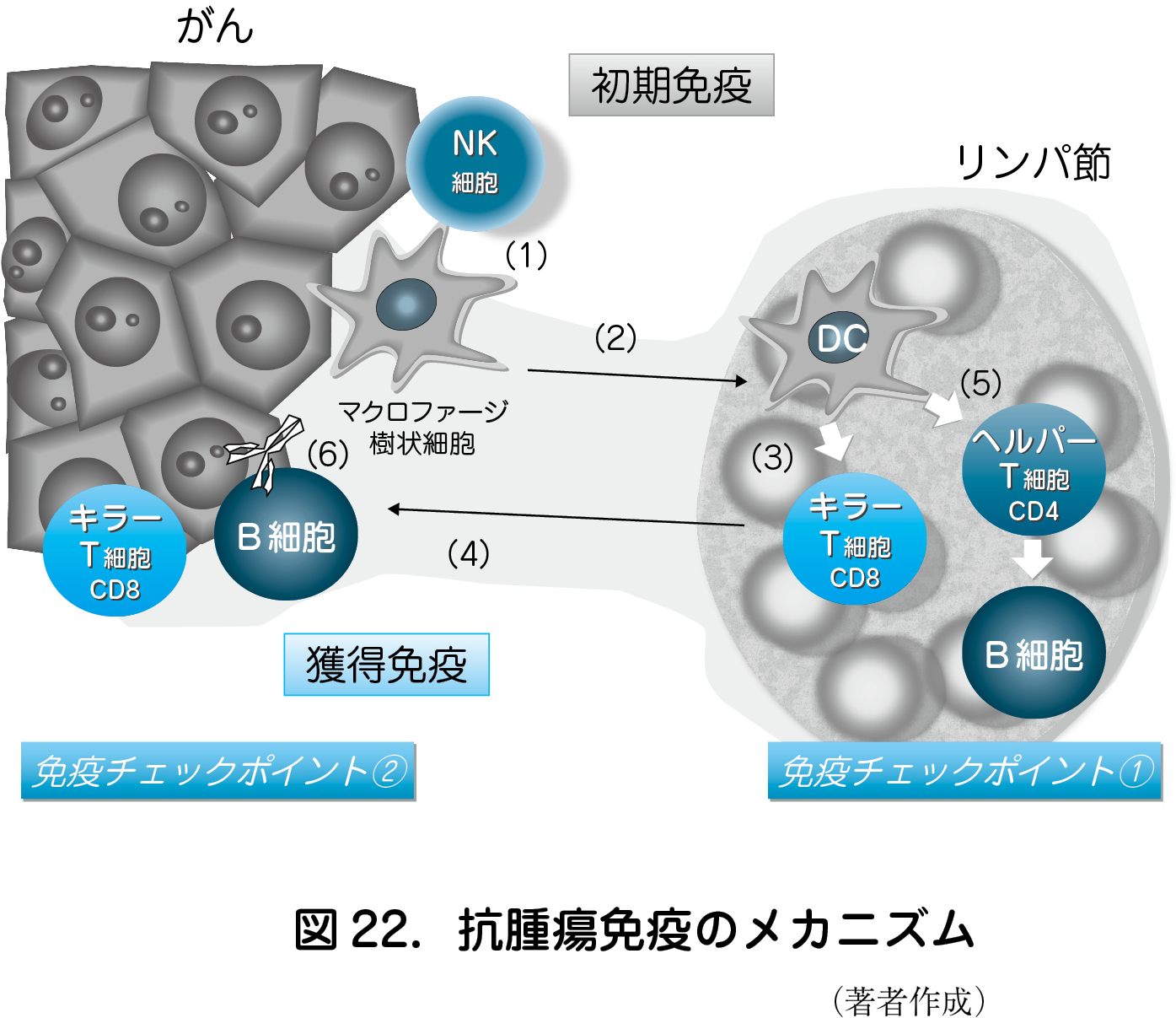
1 )抗腫瘍免疫(がん免疫監視)
一般に,生体内では異物やがん細胞に対して(図22),(1)Natural Killer(NK)細胞による細胞傷害応答やマクロファージなどの貪食細胞による抗原非特異的な初期免疫反応が起こる.さらに(2)貪食細胞のうち抗原提示能が高い樹状細胞(DC)は,リンパ節に遊走する.(3)リンパ節内で,DC は貪食したがん細胞の断片(がん抗原)を主要組織適合遺伝子複合体(MHC)上に発現し,T細胞に提示する.(4)T細胞はT細胞受容体(TCR)を介してがん細胞を認識する(第1 シグナル).その際にT細胞機能を活性化する免疫補助シグナル(第2シグナル)が働くと,T細胞のうち細胞傷害性をもつキラーT細胞(CD8+T細胞)はがん局所に遊走し,がん細胞を攻撃する(図25).また(5)T細胞のうちヘルパーT細胞(CD4+T細胞)はリンパ節内でB細胞の抗体産生細胞(形質細胞)への分化を促進する.さらに(6)産生されたがん抗原特異的抗体は,がん細胞に結合し,抗体が結合したがん細胞に対してマクロファージやNK細胞が攻撃をする(ADCC:抗体依存性細胞傷害).このようにがん細胞は,その発生や進展の過程で宿主の免疫(抗腫瘍免疫)により監視され排除(がん免疫監視機構)される.
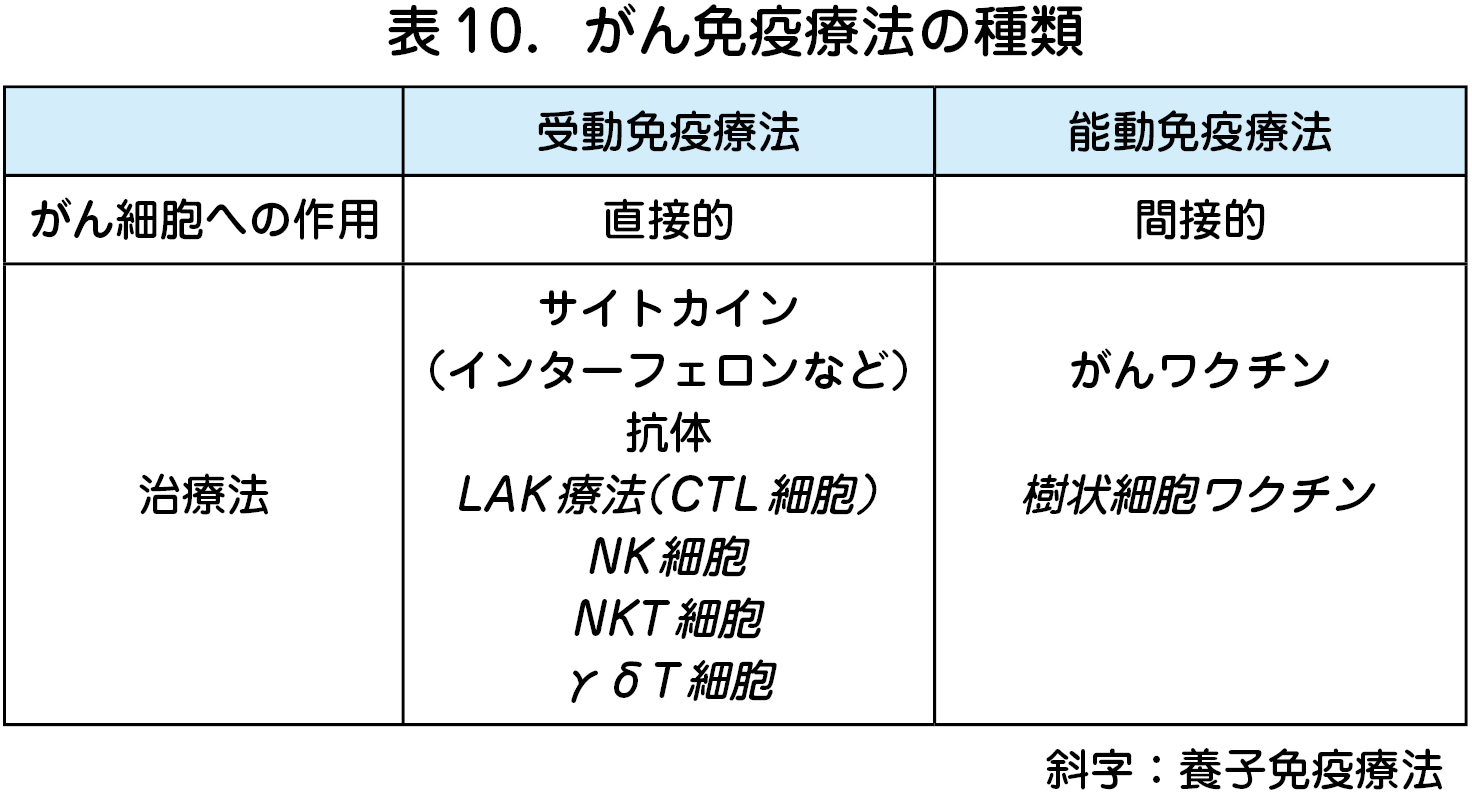
2 )養子免疫療法
養子免疫療法とは,免疫細胞を投与し抗腫瘍免疫を増強するがん免疫療法の一つである.腫瘍免疫を増強する方法には,がん細胞へ直接作用する受動免疫療法と能動免疫療法がある(表10).一般に,受動免疫療法では,DC やT細胞を活性化するインターフェロンやインターロイキンなどを投与するサイトカイン療法や,生体内のCD8+T細胞(LAK療法)やNK細胞(NK細胞療法)などの免疫細胞を末梢血から分離し,サイトカインなどを添加した一定の培養条件で増幅,活性化してまた体内に戻す治療法が開発された.またさらに腫瘍内のT細胞(TIL:腫瘍内浸潤T細胞)を腫瘍から分離し,上述と同様な処理の後に体内に投与するTIL療法も試行された.このように末梢血や腫瘍から特定の免疫細胞を体外に取り出し,生体内に投与するLAK, NK およびTIL 療法を養子免疫療法という.
一方,能動免疫療法として,がんワクチンがあり,体外でがん抗原を貪食したDCを増幅・活性化し生体に投与するDC療法も養子免疫療法の一つとして注目された(表10).しかしながらこのような従来型の養子免疫療法は,がん免疫逃避機構(後述)のため,治療効果は非常に限定的で,臨床の場に広く普及することはなかった.
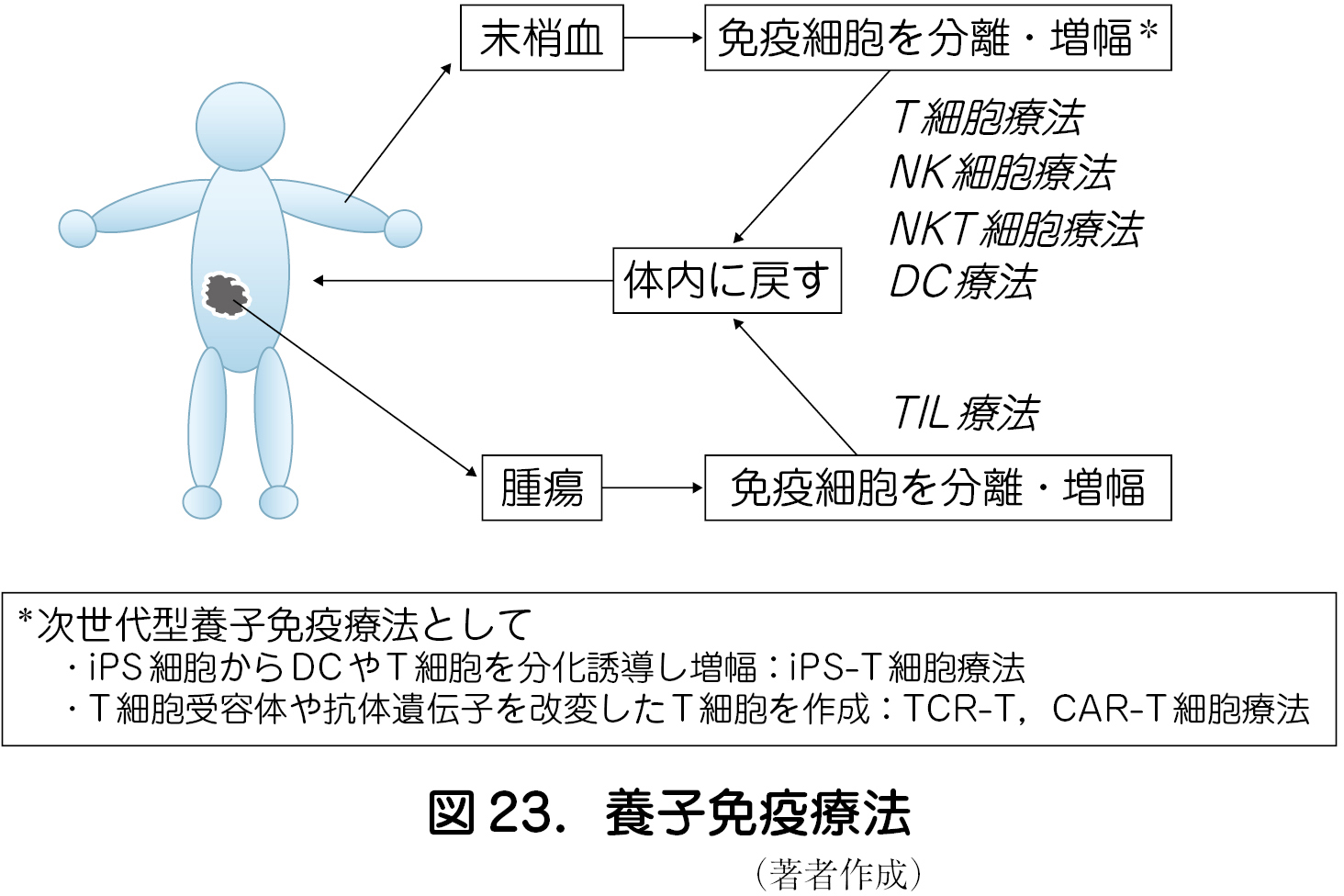
近年,分子生物学と細胞工学の発展によって,養子免疫療法においても変革が起きている.再生医療の急速な展開を背景に,人工多能性幹細胞(iPS)細胞からDC やT細胞を分化誘導し細胞を増幅してがん治療に応用する試み(iPS-T細胞療法)や,遺伝子組み換え技術により,目的のがん抗原を認識するT細胞受容体の遺伝子を改変したT細胞を用いる治療(TCR-T細胞療法)や,がん細胞に特異的な抗体の抗原認識部位と免疫補助刺激受容体およびCD 3ζ鎖を融合して作製したキメラ抗原受容体(CAR)を発現させたT細胞を用いる治療(CAR-T細胞療法)などが次世代型の養子免疫療法として注目されている.特にB 細胞系腫瘍に対するCD19を標的とするCAR-T細胞療法は,80 %以上の症例が完全奏効と報告されており,その優れた治療効果から2018 年に米国食品医薬品局(FDA)に薬事承認され,固形腫瘍に対しても新しい治療法の一つとして期待されている(図23)
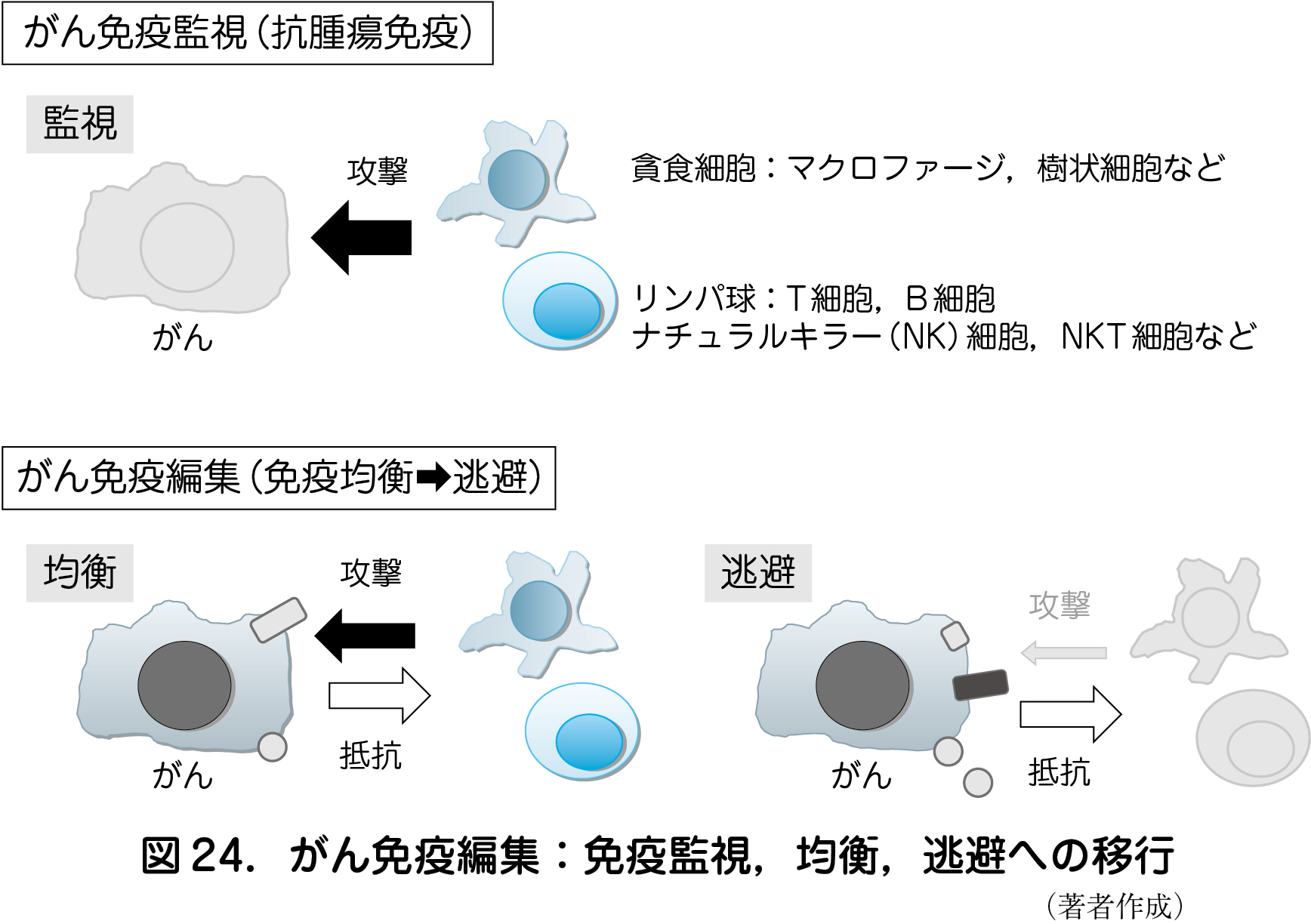
3 )がん免疫逃避機構
がん細胞に対して,抗腫瘍免疫(免疫監視)が存在するにもかかわらず,がんは増殖し顕在化する.これまで抗腫瘍免疫を促進・増強するような様々ながん免疫療法を駆使してもその効果は少なかった.その原因としてがん細胞によるがん抗原やHLA発現の低下・消失,免疫抑制物質の発現や分泌,免疫抑制性細胞(制御性T細胞や骨髄由来抑制細胞)の誘導を介して,がん免疫の監視と拮抗(免疫均衡)し,最終的には逃避するという一連のメカニズム(がん免疫編集)の存在があり(図24),この免疫抑制状態を解除する治療法の開発が急速に進んでいる.
4 )免疫チェックポイント
上述の抗腫瘍免疫のメカニズムにおいて,樹状細胞からT細胞への抗原提示およびT細胞ががん細胞を攻撃する際に,第2 シグナル(免疫補助シグナルともいう)が働くが,これには促進型と抑制型があり,促進型の免疫補助シグナルが働くと,T細胞が活性化し抗腫瘍免疫へと向かう.一方で抑制型の免疫補助シグナルが働くと,T細胞はがん抗原を認識しても活性化することはなくがん細胞を攻撃できない状態になる.このように免疫の状態を決定するメカニズムを免疫チェックポイントと呼ぶ.

① B7/CTLA-4 経路と阻害薬
免疫チェックポイントのなかで,代表的な抑制性の免疫補助シグナルの一つが,T細胞上に発現する細胞傷害性T リンパ球抗原4(CTLA- 4)受容体と,抗原提示細胞に発現するB7(B7-1:CD 80,B7-2:CD86)分子とのB7/CTLA 4 経路である(図25).すなわち,補助シグナルB7/CD28経路によって活性化したT細胞に対してCD28に競合的に結合することで,T細胞免疫活性を収束させ,過剰なT細胞免疫応答を抑制する.このB7/CTLA-4経路を阻害抗体で遮断すると強い免疫活性を誘導し,腫瘍増殖が抑制される.
現在,悪性黒色腫に対して完全ヒト型抗CTLA-4抗体イピリムマブが従来の化学療法に比して全生存期間を延長したことから本邦でも薬事承認され,他の薬剤を組み合わせた併用療法が盛んに行われている.一方で,生体内の全身の免疫抑制を解除することから様々な自己免疫疾患様の副作用も報告されている.
② PD-1/PD-L1 経路と阻害薬
現在,最も注目されている免疫チェックポイントが,Programmed cell death-1(PD-1)とそのリガンドPD-L1(PD-L2)経路である.PD-1(CD 279)分子も,CD28ファミリーに属する免疫抑制性補助シグナル受容体であり,活性化したT細胞,B 細胞および骨髄系細胞に発現し,抗原特異的にT細胞活性を抑制する.PD-1のリガンドには,免疫補助シグナルB7ファミリーに属するPD-L1(CD274 , B7 -H1)とPD-L2(CD273 , B7 -H2)があり,PD-L1は樹状細胞ほか血管や心筋,肺,胎盤などに幅広く発現しているが,PD-L2は樹状細胞にのみ発現する.PD-1/PD-L1経路は,自己免疫反応や炎症反応を鎮静化することから,前述のB7/CTLA4経路とともに免疫系の恒常性の維持にかかわっている(図25).またPD-1経路は,主に末梢組織のリンパ節で抗原情報をもつ樹状細胞からT細胞へ抗原を提示する際に働き,標的細胞(がん細胞)の免疫逃避にかかわる.PD-1経路の阻害によってT細胞の再活性化が生じ,がん特異的免疫反応が誘導され,抗腫瘍効果を認めることが示され,臨床応用が進んだ.
現在,抗PD-1抗体(ペンブロリズマブ,ニボルマブ)および抗PD-L1抗体(アテゾリズマブ,アベルマブ,デュルバルマブ)が,悪性黒色腫,非小細胞肺癌,腎癌,膀胱癌などの固形腫瘍やホジキンリンパ腫などの血液腫瘍に対して,薬事承認されている.これらの抗体薬については,さらに他のがん腫でも適応拡大に向けた動きが加速している.また同時に他の抗がん薬(化学療法,分子標的療法,免疫療法,放射線療法など)との併用療法の臨床試験も数多く行われており,公開情報によると,7 種類以上のPD-1経路阻害薬(抗PD-1抗体,抗PD-L1抗体)が,50 種類以上のがん腫に対して,1,000 以上の臨床試験(治験)として実施されている.既にFDA では悪性黒色腫に対して,ニボルマブと抗CTLA-4抗体イピリムマブの併用療法や,非小細胞癌に対する標準化学療法にペンブロリズマブを併用した治療法も承認されている.本邦では再発卵巣癌に対してニボルマブを用いた第Ⅱ相試験が行われ,効率15%で,完全奏効した2 例は3 年以上無治療で無再発生存し,現在第Ⅲ相試験にて有効性が検証されている.一方大腸癌や子宮体癌のなかでDNAミスマッチ修復異常(MMRd)あるいはマイクロサテライト不安定性が高い(MSI-H)がんでは,遺伝子変異数が多く変異した新規抗原が多く免疫活性が働くとともに米国では,上述のPD- 1経路を介した免疫抑制も進んでいることから,ペンブロリズマブが有効であることが示され,薬事承認されている.
今後は,さらにPD-1経路阻害薬の適応拡大が婦人科腫瘍含めさらに拡大することが予想されるが,高額な治療薬であるため有効性を予測する有効なバイオマーカーが必須であり,また特有の免疫学的有害事象への対応や最適な併用療法の探索・検証が求められている.

