妊娠維持機構/ 流産に関連するトピックス
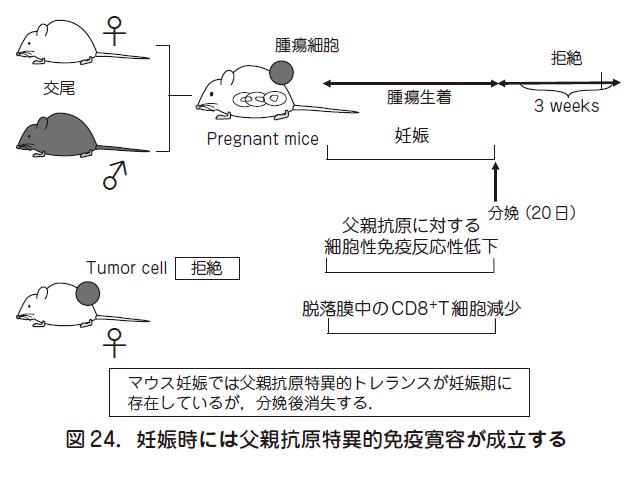
妊娠は,母親にとって異物である胎児を許容するという現象である.古くから着床した胚の周囲に多くの母体リンパ球が集簇していることが知られている.つまり子宮内膜上皮の基底膜を通過して母体間質に侵入した胎児は,母親に認識されていることになる.本来は,免疫学的に拒絶される胎児が拒絶されないのは,妊娠時に免疫学的寛容(トレランス)が存在するからである.このトレランスを獲得することにより,真胎生(胎盤を持ち子宮内で発育し,出生後は母乳で育つ)動物が地球上で繁栄することになった.図24 に示すごとく,C 57 B 6(B 6)マウス由来(黒マウス)の腫瘍細胞を白色のBalb/c マウスに移植すると,腫瘍細胞は認識され,腫瘍は拒絶される(図24).しかし,Balb/c ♀マウスをB 6 ♂マウスと交配してからB 6 マウス由来腫瘍細胞をBalb/c ♀マウスに移植すると,腫瘍は生着する.重要なことに,妊娠が終了後,3 週間以内に,一旦生着した腫瘍は拒絶されてしまう.即ち,妊娠期間中に限って父親抗
原特異的トレランスが存在することになる.その傍証として,母親のリンパ球の父親リンパ球に対する反応性の低下や,脱落膜中での細胞傷害性T(CD 8+T)細胞の減少が報告されている.本項では妊娠維持機構の破綻と流産につき,制御性T 細胞,NK細胞,絨毛外トロホブラスト,サイトカインの立場から概説する.
1.トレランスを誘導する細胞は制御性T 細胞である
1995 年にSakaguchi らにより,CD 4+CD 25+T 細胞に免疫抑制活性があることが証明され,制御性T(Treg:regulatory T)細胞と命名された.その後,制御性T 細胞を除去すると全身性の自己免疫疾患が発生すること,免疫寛容を引き起こすのは制御性T 細胞であることが証明された.妊娠における制御性T 細胞の役割については,2004 年にAluvihare らが制御性T 細胞を除いたマウスではアロ妊娠(父親と母親の主要組織抗原が異なる妊娠:ヒトではすべてアロ妊娠)で流産が起こること,ヒト妊娠でも末梢血,脱落膜中で制御性T 細胞が増えるが,特に脱落膜では末梢血に比し約3倍に増加すること,流産や不育症例での流産では末梢血ならびに脱落膜中の制御性T細胞のレベルが非妊婦と同等になることから,ヒトの妊娠維持に制御性T 細胞が重要であることが報告された.
その後の研究により,精漿中に含まれる父親抗原により,父親抗原特異的制御性T細胞が誘導され,着床に役立っていること(制御性T 細胞を着床期に除くと着床不全となる)が,マウスで証明された.またエストロゲンやプロゲステロンは制御性T 細胞を増加させ,妊娠時の制御性T 細胞の増加に関与していることも明らかになった.制御性T 細胞には胸腺由来のものと,胸腺外で分化するものが存在する.前者が70%,後者が30%を占める.興味深いことに,胸腺外制御性T 細胞の誘導に必要なCNS 1 領域のエンハンサー領域の塩基配列は胎盤哺乳類では高いホモロジー(類似性)を持つが,非真獣類哺乳類(ワラビ―,カモノハシなど哺乳動物だが胎盤はない)では,その塩基配列は大きく異なっている.すなわち胎盤を持つ動物だけが胸腺外制御性T 細胞を持っている.それでは,制御性T 細胞が減少することが,ヒト流産の原因となるのであろうか.
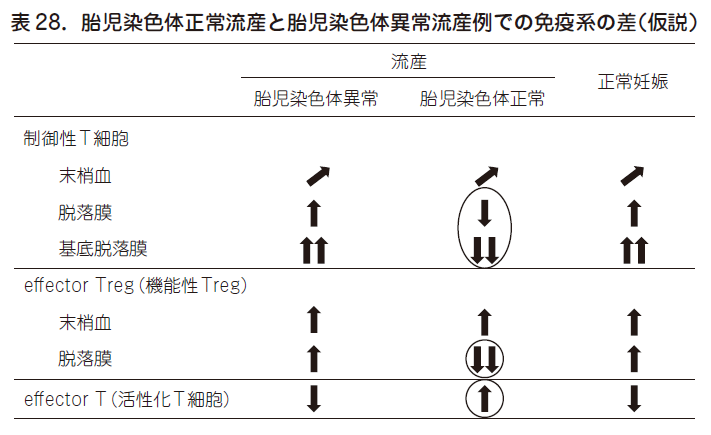
図25 に示すごとく,流産を繰り返す不育症の中で,リスク因子を同定できるのは35 %にすぎず,65 %はリスク因子不明/ 偶発的流産(胎児染色体異常による流産を繰り返した症例)となる.65 %のリスク因子不明症例の一部が,トレランスの破綻による流産であろうか?これらの疑問を解き明かすためには,胎児染色体正常流産と胎児染色体異常流産とで,制御性T 細胞の差異を明らかにする必要がある.表28 に示すごとく,胎児染色体正常流産例に限って脱落膜(特に着床部にあたる基底脱落膜)で制御性T 細胞がとくに制御活性の強いeffector Treg 細胞が減少している.また活性化T 細胞も染色体正常流産例に限って脱落膜で増加している.一方,これらの免疫学的変化は末梢血では観察されない.これらのことは,ヒト流産においても,母子接点の場での制御性T 細胞が減少することによる免疫学的妊娠維持機構の破綻により拒絶反応が起こり,流産が起こっていることを示唆している.

2.流産胎児が母体免疫細胞により攻撃されているか?
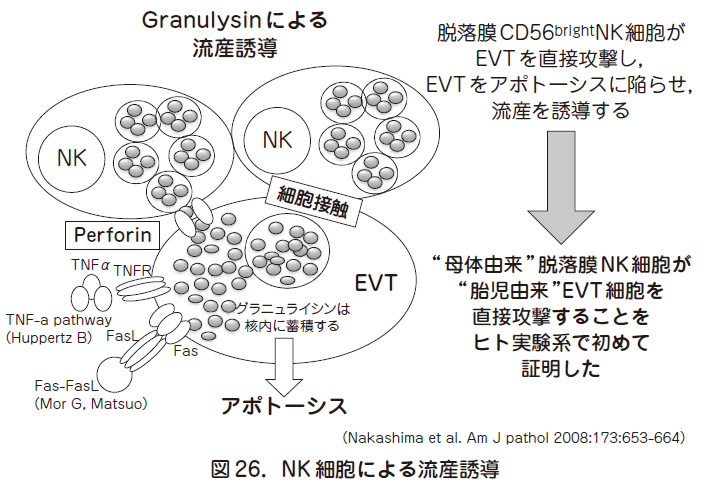
胎盤を形成しているトロフォブラストは子宮内膜や子宮筋まで浸潤する絨毛外トロフォブラスト(EVT:extravillous trophoblast)と,絨毛を形成し胎児の栄養補給に重要な絨毛トロフォブラスト(villous trophoblast)に大別される.移植抗原の中で,HLA-C のみがEVT に発現しており,母子間のHLA-C のミスマッチ(不一致)がある際に,脱落膜中のリンパ球が活性化されている事が知られている.HLA-C はNK 細胞とT 細胞により認識される.いずれの細胞も細胞傷害性顆粒が標的細胞(流産の場合はEVT)に向かって放出され,標的細胞は死に陥る.子宮内膜中のリンパ球構成は末梢血と大きく異なっており,末梢血では1 %以下のCD 16-CD 56brightNK 細胞が約80 %を占める.細胞傷害顆粒はパーフォリン,グランザイム,グラニュライシンが知られているが,流産例ではNK 細胞内のグラニュライシンが増加している(図26).グラニュライシンは核内に移行する事で標的細胞にアポトーシスを引き起こす.興味深いことに流産例において,EVT の核にグラニュライシンが局在しており,しかもこれらの細胞がアポトーシスに陥っていることが証明されているので,ヒトの流産例で母体リンパ球が直接胎児由来のEVT を攻撃し,死に陥らせていることが明確になっている.
3.制御性T 細胞は着床期と妊娠初期に重要な役割を果たす
マウスにおける詳細な解析により,父親抗原特異的制御性T 細胞は,着床1 日前にすでに子宮領域リンパ節である傍大動脈リンパ節に集簇してくる.着床と同時に,領域リンパ節から子宮へ父親抗原リンパ節が流入し,妊娠経過とともに子宮での父親抗原特異的制御性T 細胞数,率ともに増加する.このプロセスに精漿のプライミングが重要である.IVF-ET では,精漿によるプライミングが抜けているが,妊娠は成立する.明らかなエビデンスとはなっていないが,IVF サイクル中に禁欲せず,性交渉を持った方が,妊娠率,生児獲得率が高かったとする報告もある.このように精漿のプライミングは妊娠成立に必須ではないが,有益に作用している.
では,制御性T 細胞を除くと着床不全や流産が起こるのであろうか?マウスの系では,アロ妊娠では,着床不全や流産が生じるが,同系妊娠では,妊娠合併症は生じない.しかし,妊娠中期以降に制御性T 細胞を除去しても,妊娠経過には変化を認めない.これらの事により,制御性T 細胞は妊娠の極めて初期の段階で重要な役割を果たしていると考えられている.
制御性T 細胞は腸内細菌であるClostridium 属が,その分化に重要な役割を果たしている.そのため,不妊症や不育症例の腸内細菌叢の変化にも注目が集まっている.また,原因不明の着床不全や不育症例に対して,大量γ グロブリン(IVIG)療法が試みられているが,免疫グロブリンには制御性T 細胞を増加させる作用が知られており,これらの作用により着床不全や流産が解消したのかもしれない.
4.サイトカインと着床不全,流産
サイトカインとは主として免疫細胞などから分泌される物質で,局所で作用する.妊娠に好影響を与えるサイトカインとしてIL- 10,TGF-β などの免疫抑制活性を持つサイトカインが知られている.一方,妊娠に障害作用を持つサイトカインとして,IL- 2,TNFα ,インターフェロンγ(IFNγ ),IL- 17 等のサイトカインが知られている.これらのサイトカインは,いずれもリンパ球や単球に作用し,拒絶反応を引き起こす.これらのサイトカインの中で,TNFα は最も着床障害や流産に関連すると考えられるようになってきている.TNFα は強い炎症を誘導し,関節リウマチ(RA)や炎症性腸疾患(IBD)に深く関与している.そのため抗TNFα 抗体製薬は,広くRA やIBDの治療に使用されている.
着床不全や不育症例に対して,米国で試験的に抗TNFα 抗体が使用され,好成績が得られている.現在,リスク因子不明の不育症例に対する抗TNFα 抗体製薬の臨床試験が米国で行われている.ただし,日本での使用にあたっては,適応外使用となるので,十分なIRB 等の許可を得た上でないと使用できない.
5.おわりに
これまで,ヒト流産における免疫の関与は,あまり知られていなかったが,免疫学的寛容の破綻が,着床不全や流産を引き起こすことが判ってきた.本項は,かなり専門的で難解ではあるが,免疫的な立場での着床不全や流産治療も試みられているため,概説した.これらの治療は,未だ始まったばかりであるため,一般的な治療法でないことをおことわりしておく.

