(2)周産期の立場から(松本 直)
近年,女性のライフスタイルの変化や生殖補助技術の進歩に伴い生殖年齢が上昇している.この結果として,悪性腫瘍治療後のいわゆるがんサバイバーの妊娠例や妊娠中に診断される悪性腫瘍例も増加傾向にある.特に子宮頸部悪性腫瘍の治療後妊娠例では,妊娠を維持する重要な機能を司る子宮頸部を外科的切除するため,その後の妊娠においては慎重な周産期管理を要する.また,妊娠中に診断された悪性腫瘍は,胎児への影響や妊娠合併症の回避などの点から検査や治療に難渋することも少なくない.Oncofertility,いわゆる癌生殖医療という言葉が最近よく聞かれるようになっているが,ここでは,癌治療と周産期医療,すなわち,oncoperinatology の面から,1)妊娠中に診断された子宮頸部細胞診異常の取り扱い,2)子宮頸部円錐切除後妊娠の周産期管理とその転帰,3)広汎性子宮頸部摘出術後妊娠の周産期管理,4)妊娠初期に診断された卵巣腫瘍の取り扱い,5)妊娠中および授乳期の化学療法について述べる.
1 )妊娠中に診断された子宮頸部細胞診異常の取り扱い
・子宮頸癌の約3 %は妊娠中に発見されるが,その多くは無症状であることから,「産婦人科診療ガイドライン産科編2017」のCQ 002「妊娠初期に得ておくべき情報は?」においても「子宮頸部細胞診検査を行う.(B)」と検査の実施が推奨されている.
・妊娠中の細胞診異常の頻度は約1 . 4 %と報告されている.細胞診異常が認められた場合,非妊娠時と同様の精密検査が必要となる(図32).
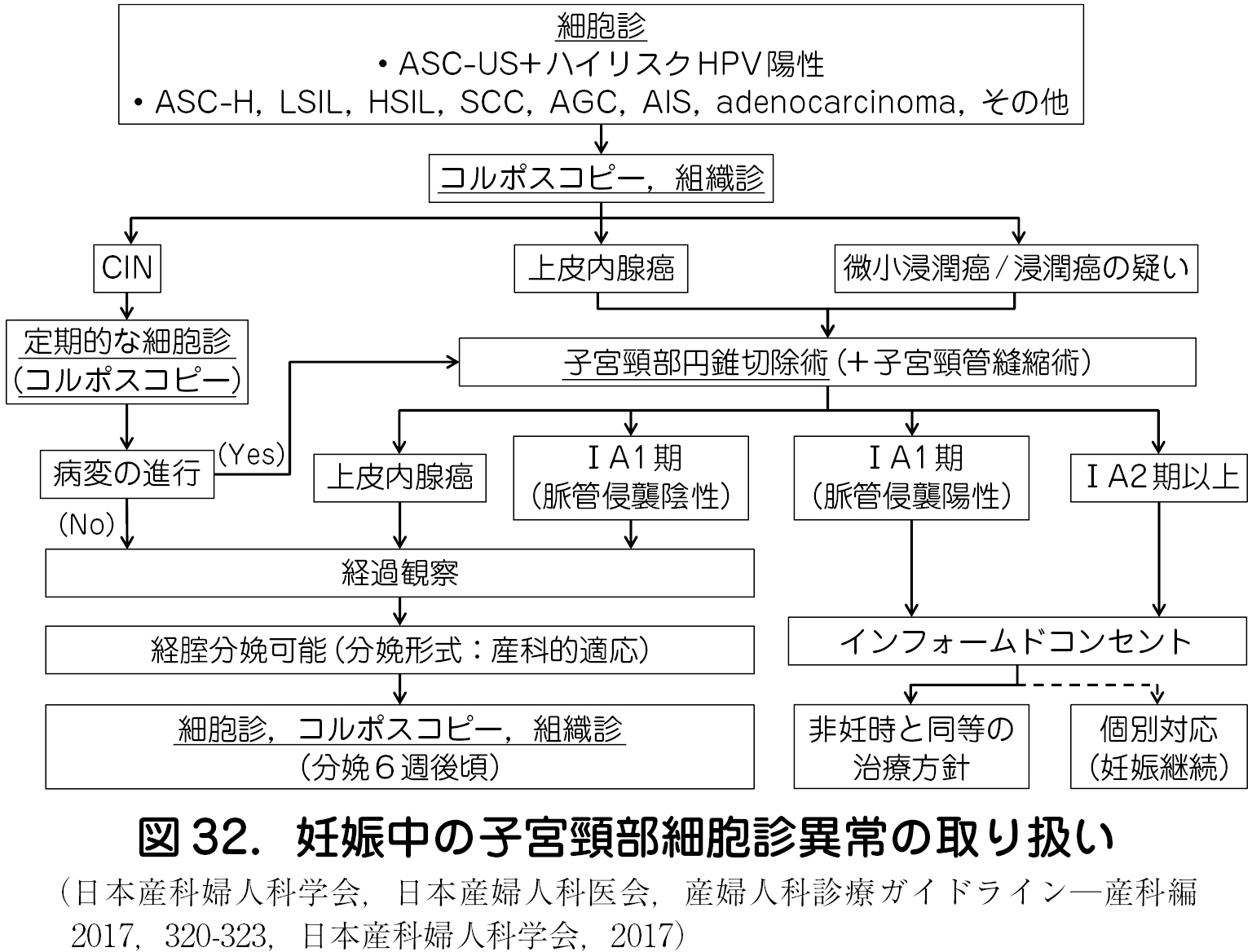
・妊娠中の細胞診は脱落膜細胞や異型化生細胞など鑑別を要する細胞がしばしば出現することや,採取の際の出血を避けるため十分な細胞採取が行われないことなどにより正確な診断が困難となることがあり注意を要する.
・妊娠中はCIN が進展する可能性は低く,分娩後に消退するという報告もある.特にCIN 1 に関しては,分娩後に自然退縮する可能性が高いとの見方もある.
・妊娠中の子宮頸部円錐切除術は残存病変が多いとされ,浸潤癌が疑われない限りは分娩後の治療が妥当と考えられている.
2 )子宮頸部円錐切除後妊娠の周産期管理とその転帰
・「産婦人科診療ガイドライン産科編2017」では,「子宮頸部円錐切除後の妊娠の取り扱いは?」というCQ 503 に対して「1.早産ハイリスクと認識して管理する,2.早産徴候(頸管長短縮,子宮収縮など)に注意する」と記載されている.円錐切除術後の妊娠では早産率が8~15%であり,対照群の1 . 5~3 倍と有意に高い.その他,子宮頸部円錐切除術後妊娠の合併症を表20 に示す.

・円錐切除術の際に切除の深さが深くなるにつれ,早産のリスクが高まるとされる.具体的には切除の深さが10㎜を越えた場合,10㎜未満と比較して早産リスクが2 . 6倍と報告されている.また,術式による早産率としては,大規模な検討がなされていないものの,メスを用いたコールドナイフ法の既往がより早産リスクが高いとする報告が多い.円錐切除後妊娠の周産期管理の際は,術式の詳細な確認が重要である.
・円錐切除後妊娠に対するルーチンの予防的頸管縫縮術の有効性は示されていないものの,妊娠中期までに頸管長が明らかに短縮している症例や,円錐切除後の既往妊娠において頸管の脆弱化による流早産が疑われる症例に対しては予防的頸管縫縮術などが考えられる.
・円錐切除後妊娠における新たな治療戦略として,頸管縫縮術に加えてプロゲステロン製剤を用いる方法や,経腟的に腹膜を開放し子宮頸峡部を縫縮する方法,さらには経腟的なアプローチが困難な症例では,経腹的なアプローチによる頸管縫縮術などが考えられる.特に経腹的頸管縫縮術は,開腹によるもののみならず,腹腔鏡を用いてロボット支援下で実施された症例も報告されている.
3 )広汎性子宮頸部摘出術後妊娠の周産期管理
・広汎性子宮頸部摘出術(RT:Radical Trachelectomy)は1986 年にDargern らにより実施されて以降,急速に普及しつつある早期子宮頸癌に対する妊孕能温存手術である.RT 施行例の増加に伴い術後妊娠例の報告も増えつつあるが,現状ではRT後妊娠の周産期管理方法について一定の見解が得られていない.本邦において周産期管理経験の比較的多い施設での管理方針を(表21)に示す.

・RT 後妊娠の合併症としては,早産や早産期前期破水,残存子宮頸部静脈叢からの出血などが挙げられる.妊娠34 週未満の早産例では,早産期前期破水や絨毛膜羊膜炎が多く,子宮頸部の機械的支持の減少や頸管粘液の欠如による感染防御機構の破綻などが原因として考えられる.一方,残存子宮頸部静脈叢からの出血は妊娠中~後期に認めやすく,ガーゼ圧迫による止血やアルゴンレーザーもしくは電気凝固による止血術が有効とされる.
4 )妊娠初期に診断された卵巣腫瘍の取り扱い
・妊娠中に発見される卵巣腫瘍の頻度は,本邦では0 . 21~1 . 24%と報告されている.また妊娠中に発見される卵巣腫瘍のうち,卵巣癌(境界悪性,悪性)は1~3 %を占める.
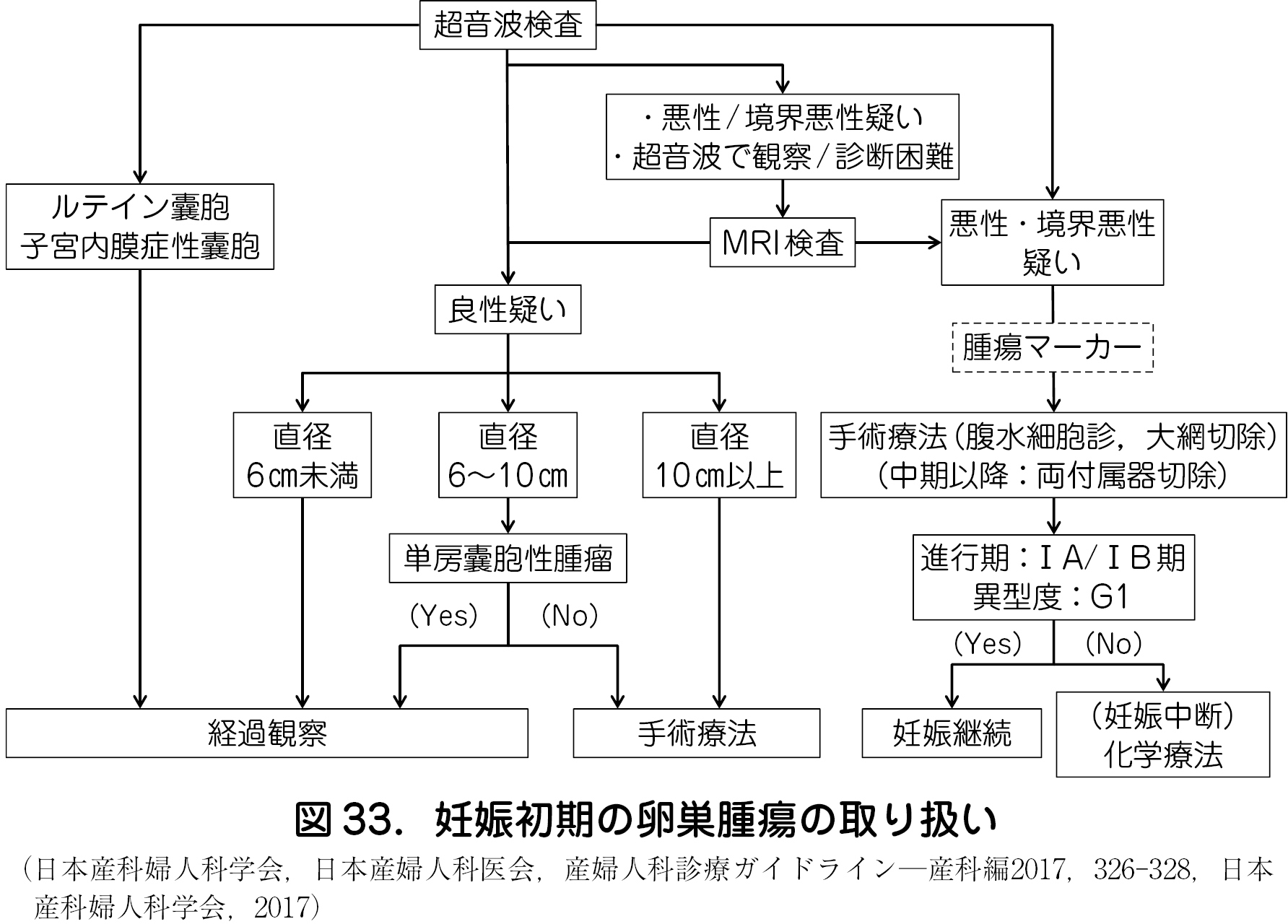
・「産婦人科診療ガイドライン産科編2017」(「CQ 504 妊娠中に発見された付属器腫瘤の取り扱いは?」)による妊娠初期に診断された卵巣腫瘍の取り扱いとして,まず超音波検査により腫瘤の形状を観察し,良悪性の評価を行い,良性腫瘍が疑われる場合は原則的に非妊娠時の対応に準じる.一方,悪性または境界悪性が疑われる場合,大きさや週数にかかわらず,原則として手術を選択する(図33).
・悪性もしくは境界悪性が疑われる場合や超音波で観察が困難な部位にある場合,診断に迷う場合は,積極的にMRI 検査を実施する.妊娠初期に実施したMRI 検査およびガドリニウム造影剤の胎児への影響としては,単純MRI 検査であれば,非実施例と比較し,成長障害,視力,聴力,発がんなど明らかな影響は認められない.
一方,ガドリニウム造影剤の使用については,非使用例と比べ,リウマチ様皮疹,炎症性皮膚症状などの出現率や新生児死亡,死産の頻度が上昇するとする報告もある.
・腫瘍マーカーのうちCA 125,AFP,hCG などは妊娠中に生理的に上昇するので鑑別には有用でない.一方,CEA,SCC,CA 19 – 9,STN などは妊娠による影響は受けない.
5 )妊娠中および授乳期の化学療法
・妊娠中の悪性腫瘍の合併の頻度は0 . 05~0 . 1%程度とされており,疾患別では,乳がんや血液腫瘍が多く,化学療法が治療の選択肢となる疾患である.しかしながら,多くの抗癌剤は人体への催奇形性の懸念から,本邦における添付文書でも禁忌,もしくは原則禁忌とされている.
・妊娠時期別では,妊娠第1 三半期(first trimester)は器官形成期であり,抗癌剤の暴露で重篤な構造異常を生じるリスクが高い期間である.一方,妊娠第2 三半期以降では胎児奇形の発生頻度は1 . 3%程度と低率であるとされ,リスクとベネフィットを考慮した上で抗癌剤の投与が可能であるとされる.それぞれの薬剤についてのデータは不足しがちであり,安全性を担保する明確なデータはなく,妊娠第2 三半期以降では胎児奇形の発症率は低下するものの,胎児発育不全や早産のリスクが上昇する可能性にも配慮する.
・母体に投与された抗がん剤が胎盤を介して胎児へと移行し,胎児骨髄抑制を生じることがある.出産時の児出血や感染の危険性が上昇する可能性があるため,出産予定日の3~4 週以内の抗癌剤投与は避けるべきとされている.また,分娩後の授乳は抗癌剤の母乳移行性を勘案すると原則禁忌である.
6 )おわりに
周産期医療の立場から妊娠と癌治療について解説した.妊娠初期に診断された悪性腫瘍の場合,原則的には母体優先として治療にあたるべきである.しかしながら少子高齢化を迎えた今日,高齢初産の妊婦において妊娠初期に子宮頸癌や卵巣癌が発見された場合,一概にそのように割り切れないケースにも時として遭遇する.患者が妊娠の継続を希望した場合,婦人科医,産科医,新生児科医が連携し,協議した上で,母児にとって最良の選択を提供することが重要である.

