(1)遺伝性婦人科がん
1 )遺伝診断とカウンセリングの実際(三宅秀彦)
①遺伝情報の特性と遺伝カウンセリング
人の遺伝情報には,表13 のような特性がある.よって,その取り扱いには,個人情報として保護するだけでなく,家族の問題や,遺伝情報によって判明する将来の症状といった,心理社会的課題についても配慮を要する.遺伝情報を用いた診療においては,遺伝カウンセリングの実施が考慮され,その提供が保証される必要がある.
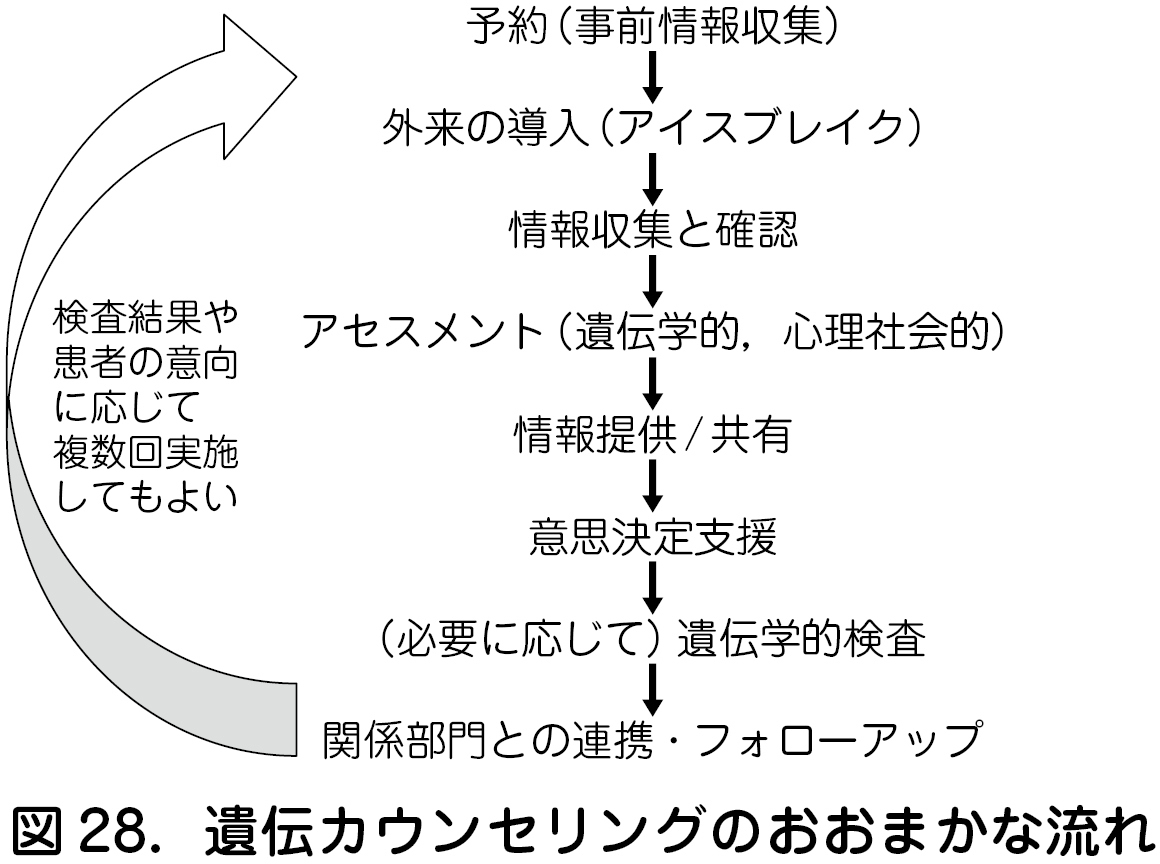
遺伝カウンセリングのおおまかな流れを図28 に示す.遺伝カウンセリングでは,患者や家族の情報を収集し,多面的にアセスメントを行い,その上で必要な情報を提供/ 共有し,クライエントの意思決定支援を行う.遺伝学的検査も,必要に応じて行う.その他,診療に関連する各部門との連携の調整など,フォローアップも,遺伝診療の重要な業務のひとつである.

②家族性/ 遺伝性腫瘍の遺伝学的検査
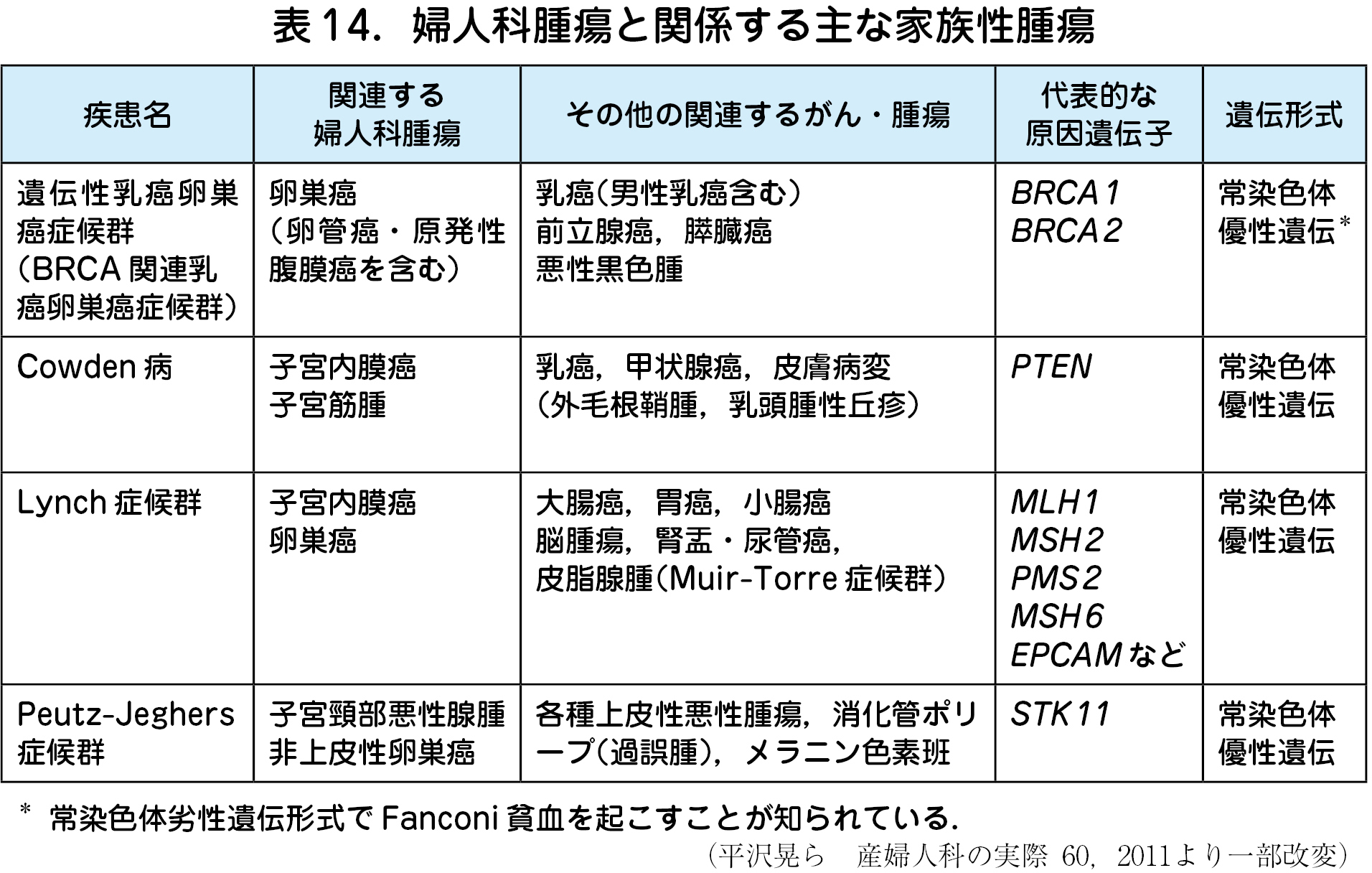
婦人科腫瘍の発症と関連とする代表的な家族性腫瘍を表14に示す.多くの遺伝性/ 家族性腫瘍の確定診断には,生殖細胞系列に責任遺伝子の病的変異を確認することが必要になる.遺伝学的検査前には,医学的マネジメントの方針決定といった検査の意義,精度や限界,心理社会的側面を含めたリスクを分かりやすく伝える.検査結果は,病的/病的の疑い/意義不明/良性の疑い/良性,の5 段階で判定される.もし,意義不明の変異が見つかった場合は,臨床的には検査を行っていない状態として対応する.
数十種の責任遺伝子を同時に調べるパネル検査で想定外の遺伝子に病的変異が見つかる場合や,網羅的な体細胞遺伝子検査から生殖細胞系列の遺伝子変異が見つかる場合がある.これらは二次的所見と呼ばれ,網羅的検査を実施する前の説明時に遭遇することは,必ず念頭に置いておく.
既に疾患を発症している患者に対して遺伝学的検査を実施する際,そのインフォームドコンセントは診療を担当する医師が行う.検査実施時に考慮される説明内容の例を表15 に示す.詳細な説明が難しい場合や,患者や家族の意思決定に対する支援が必要な場合では,遺伝カウンセリングの対応が可能な機関に紹介する.遺伝カウンセリングを専門とする資格としては,臨床遺伝専門医と非医師の資格として認定遺伝カウンセラーがある.

③家系図の描き方
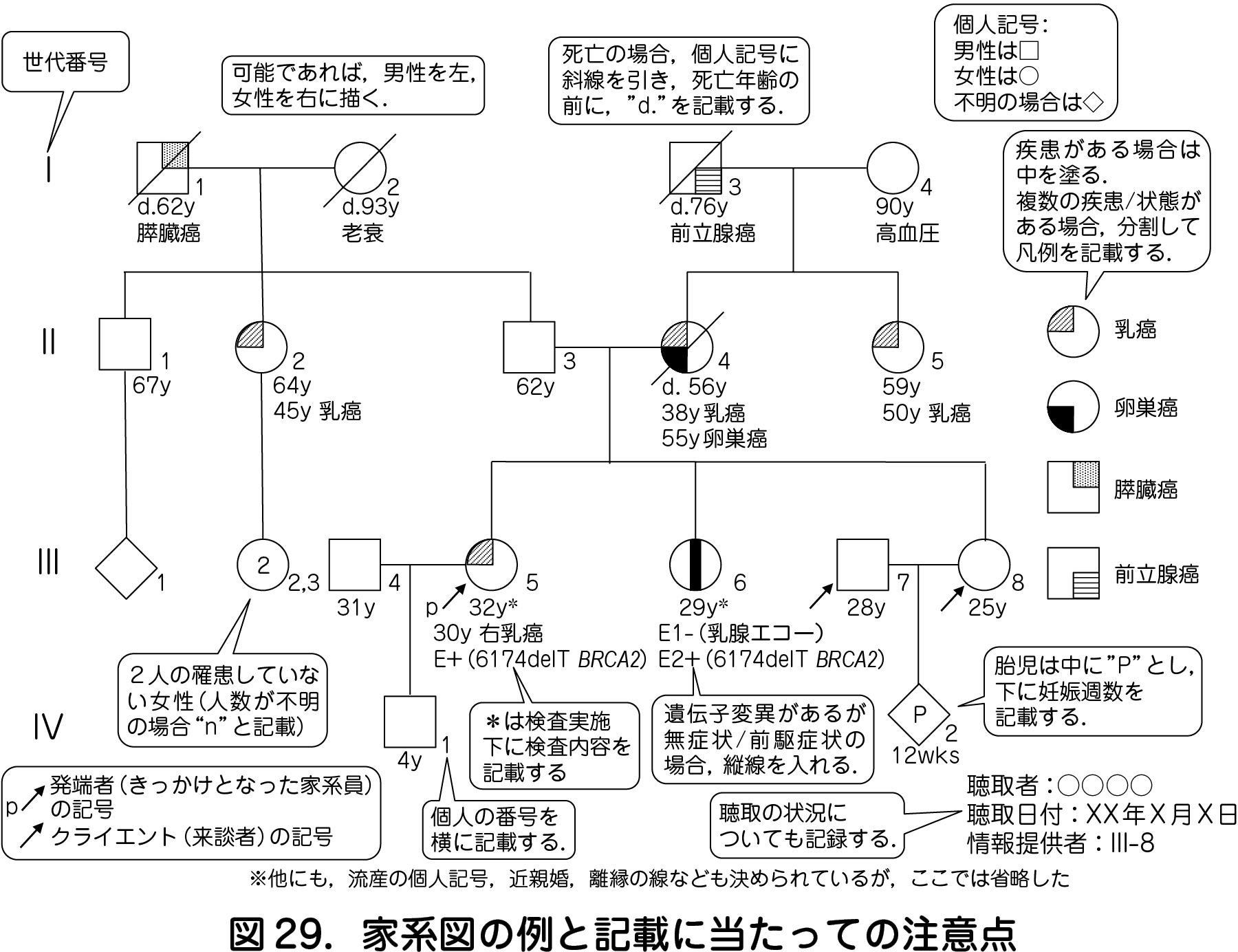
遺伝医療で用いる家系図は,米国遺伝カウンセラー学会が提唱する標準記載法に基づいて記載される.この記載法に基づく家系図の例を図29 に示す.
家系図は,遺伝形式を推測するために,少なくとも三世代にわたる聴取が必要である.家族性腫瘍では,年を経ることによって新規にがんを発症する人が増えるため,作成日時を記載し,誰から聴取したかを明記する.また,腫瘍を高頻度で合併する先天性疾患もあり,腫瘍の情報に限らず家族歴を聴取することも大切である.
2 )遺伝情報に基づくがん予防―基盤整備も含めた検討―(平沢 晃)
①はじめに
産婦人科の実地臨床は現在,「ゲノム医療実用化」の大きな潮流にある.婦人科がん領域において遺伝性腫瘍が注目されている理由としては三つの点が挙げられる.①PARP 阻害薬(poly ADP ribose polymerase inhibitor)が,遺伝性乳癌卵巣癌症候群hereditary breast and ovarian cancer syndrome (HBOC)の原因遺伝子であるBRCA 1 またはBRCA 2(BRCA 1 / 2)病的変異(バリアント)保持者に奏効する,②免疫チェックポイント阻害薬がLynch 症候群の原因遺伝子であるミスマッチ修復遺伝子の機能不全例で感受性が高い,③がんクリニカルシーケンス(がんパネル検査)の二次的所見として遺伝性腫瘍の複数の遺伝子が同時に同定されるため(表16),臨床上の対応が喫緊の課題となる.

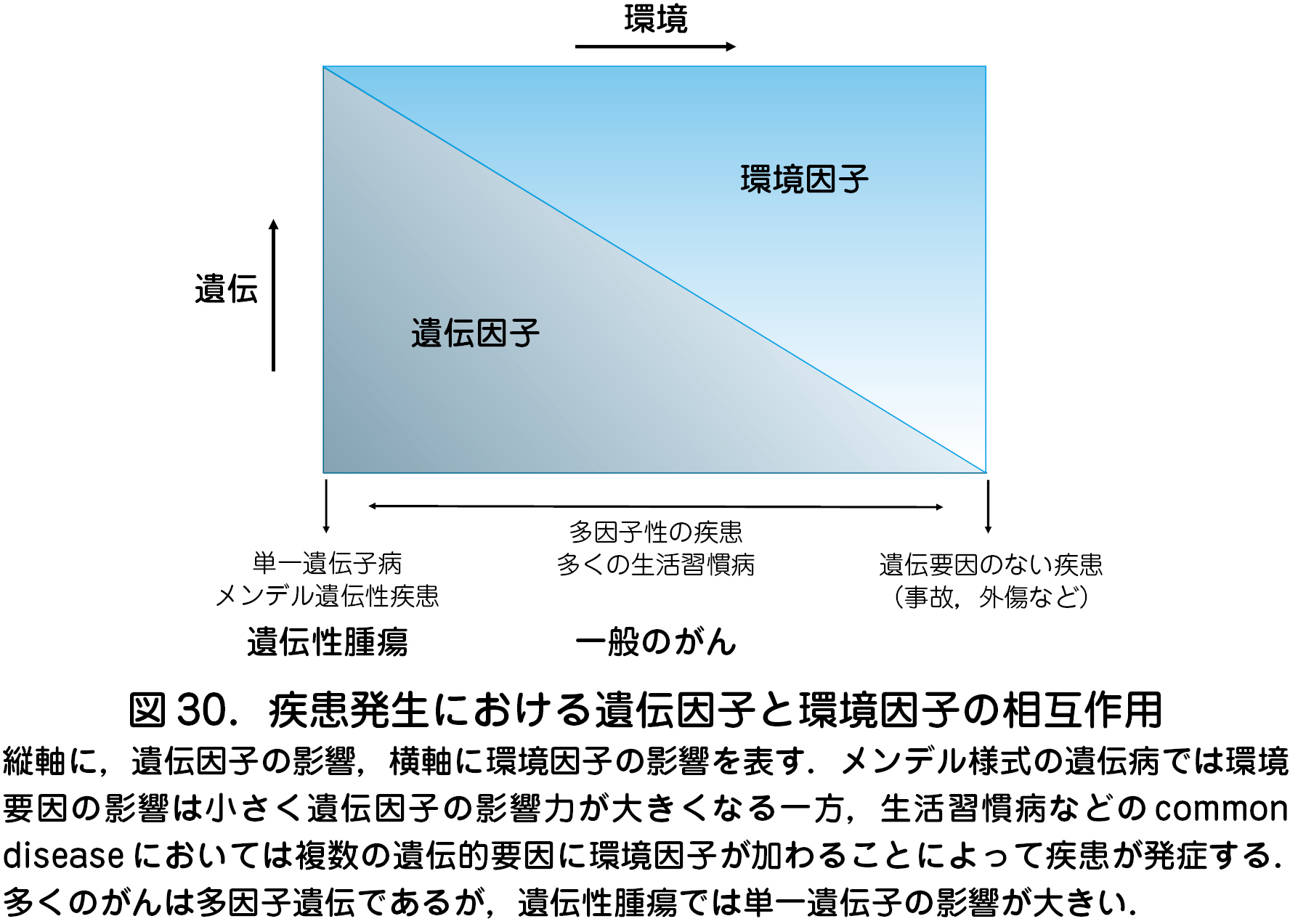
がんは遺伝因子と環境因子の双方の関与によって発生する(図30).しかしながら腫瘍関連遺伝子を生下時より保持している場合(遺伝子変異保持者),遺伝因子は環境因子より著しく大きく影響する.そのため発がん高リスク群である遺伝子変異保持者に対してがん死の低減をはかることが重要である.
そこで近未来に向けて遺伝情報に基づくがん予防を実装するために,どのような基盤整備が必要か概説する.
②質の高いバイオバンク・コホート研究の構築
新規診断法,予防法,および治療法の開発には,質の高い医療水準のもとで収集された試料と質の高い臨床情報が不可欠である.本邦では,全国の医療機関や地域で多数のバイオバンクが存在する(国立研究開発法人日本医療研究開発機構バイオバンク情報一覧 http://www.biobank.amed.go.jp).これらのバイオバンクはゲノム研究で独自の研究成果や産学共同研究を産み出してきたが,ゲノム医療などへの二次利用は今後の課題である.今後わが国で,がんを含めた遺伝情報に基づく予防医療を実装するために想定される課題と対応を示す.
a.マイナンバー制度の医療およびバイオバンク・コホート研究への活用
北欧のフィンランドや,エストニアでは,バイオバンク事業に「マイナンバー制度」にあたる共通住民登録制度が活用されている.それらの国ではゲノム,トランスクリプトーム,プロテオーム,メタボローム解析などの重層オミクス解析のみならず,アーカイブのデジタル化に関する産学共同研究など,国を挙げた医療,健康・バイオ産業を育成しており,その試料識別にマイナンバーが利用される.本邦においてもマイナンバー制度をバイオバンク・コホート研究に活用することで,国民のがん予防対策構築のみならず長寿・健康・福祉に貢献可能であると考える.
重層オミクス解析
・トランスクリプトーム解析(transcriptomics):遺伝子転写産物の網羅的解析
・プロテオーム解析(proteomics):タンパク質の網羅的解析
・メタボローム解析(metabolomics):代謝物質の網羅的解析
b.日本の地勢や医療圏の特性を生かしたバイオバンク・コホート研究
近年は「医療圏」の考え方のもと,地域の気候条件に応じた医療を提供しようという考え方がある.例えば冬期の日照時間が少ない北欧やロシアでは血中ビタミンD不足による疾患やSeasonal Affective Disorders (SAD:冬期うつ病)が多くみられ,これらを「北方圏医療」として確立しようという動きがある.東西南北に国土の長い日本は,亜寒帯,温帯湿潤気候,亜熱帯と気候区分に広がっており,気候や生活習慣の異なる日本各地のバイオバンクのもつデータを国内外で相互に比較解析することは,本邦の地勢的利点を活かして取り組むべき課題である.
③データシェアリングを通したゲノム情報の活用
ゲノム情報は多くの研究者や医療者が共有・利用(データシェアリング)することで,医学・医療の発展に直結することが可能となる.がん領域ではBRCA 1 / 2 生殖細胞系列バリアントのデータシェアリングが急速に進んでいる.ところでCIMBA(TheConsortium of Investigators of Modifiers of BRCA 1 / 2)は2015 年に世界33 カ国の約3 万人のBRCA 1 / 2 変異保持者を対象とした解析からovarian cancer cluster region(OCCR)と称されるBRCA 1 exon 11 とBRCA 2 exon 11 領域に病的バリアントを有する例で卵巣癌発症が高頻度であることを明らかにした.しかしながらこの中に日本人は一例も含まれていなかった.このようにどの領域のバリアントががんを引き起こしやすいか,また低浸透率の遺伝子がどのように関与しているかについて日本人のデータは乏しい.遺伝性腫瘍診療の目的はがん予防であり,遺伝子変異保持者のなかでのリスクの層別化は,リスク低減手術による個別化予防法にも直結する課題であり,本邦におけるハイリスク群を対象としたコホート研究の確立が急務である.
2014 年に世界規模でのゲノムデータと臨床データを共有する基盤整備を目的にGlobal Alliance for Genomics and Health(GA 4 GH)が発足し,その中で代表的なプロジェクトの一つがBRCA 1 / 2 の変化の意義を共有することをめざすBRCA challengeがある(http://www.humanvariomeproject.org/brca-challenge.html).本邦では2016年よりAMED 主導でヒトゲノムバリアントと関連する疾患の情報を統合・解析する本邦発のデータベースである「臨床ゲノム情報統合データベース(MGeND:Medical Genomics Japan Variant Database)の整備事業」が開始された.
・生殖細胞系列バリアントgermline variant:生殖細胞(卵子あるいは精子)の時点で既に存在し,すべての細胞に共通して存在する遺伝子変異で,親から子に受け継がれる.これに対して体細胞変異somatic mutation/somatic variant とは,受精後に生殖細胞以外のどの細胞にも生じ得るが,子に遺伝しない.
④予防医療・先制医療に対する費用負担の低減
遺伝カウンセリング,遺伝学的検査,リスク低減手術を受ける上で,経済的要因が障壁となる可能性がある.がん関連遺伝子の遺伝子変異保持者は発がん高危険群であり,早期介入によるがん予防策をとることでがん死低減につなげることが可能である一方で,現在のところ本邦では未発症の遺伝子変異保持者の予防医療・先制医療に対しては原則として健康保険は適応されない.本邦においてもBRCA 1 / 2 病的バリアント保持者に対するリスク低減手術の医療経済的評価も報告されており,今後の当局の対応が期待される.
⑤さいごに
わが国の厚生労働省は,がんゲノム医療中核拠点病院を中心にがんゲノム医療連携病院を整備し,がんパネル検査を先進医療で実施して,薬事承認などをめざしている.これらの動きによってがんゲノム医療の均てん化が期待されるが,それに伴う二次的所見としてのがん関連遺伝子の取り扱いについても,実地臨床の課題として焦眉の急の課題であると言える.生殖細胞系列バリアントの情報は,十分な遺伝カウンセリングのもと,本人の二次癌,重複癌予防のみならず血縁者のがん予防に有効に活用することが望まれる.
明治維新以降の努力の蓄積により,日本は創薬開発にいたる前の基礎研究から臨床試験まで一貫して行うことが可能な数少ない国である.ゲノム情報に基づいたがん予防の領域の発展には,高い医療水準のもとで収集された検体と質の高い臨床情報,家系情報,およびデータシェアリング事業など国境を越えた取り組みが必要不可欠である.個別化治療の新規治療薬の多くは欧米の製薬会社が開発・製造しており,国民は多額の医療費を外国に支払っているという状況に陥っている.がん治療薬の開発で海外の後塵を拝している現状を打開し,わが国が高品質のバイオリソースを利用したがん予防医療を確立することは,次世代に対する責務であると考える.

