(1)ヒトiPS 細胞を用いた生殖細胞造成の現状と将来(佐々木恒太郎・斉藤通紀)
はじめに
近年の発生工学や幹細胞学の進歩は目覚ましく,核移植技術によるクローン動物作成やヒト多能性幹細胞(ヒトES 細胞,iPS 細胞)作製など記憶に新しい.中でもES 細胞,iPS 細胞は体を構成するすべての体細胞へと分化可能とされており,再生医療への応用が注目されている.それではこれらの細胞から精子や卵子などの生殖細胞を人工的に造成させることは可能なのであろうか?もし可能であれば,学術的,臨床的意義は大きく,生殖細胞形成という生命現象の根本的な現象解明への新たな糸口となる上,配偶子の欠如や機能低下による配偶子型不妊に対する治療につながる重要な技術革新となると予想される.一方で,生命の萌芽である生殖細胞をそうでない体細胞から作出する技術であるともいえ,安全性や倫理面から社会全体で慎重に議論を進める必要があるだろう.過去20 年間におけるマウス生殖細胞発生学に関する知見の蓄積と生殖工学技術の進歩により,ヒト生殖細胞系列の体外培養による人工造成にも少しずつ光がみえ始めてきている.本稿ではまずマウスにおいて明らかになってきた生殖細胞発生メカニズムと我々の開発した機能的なマウス生殖細胞の体外培養技術について概説した上で,ヒトiPS 細胞を用いた生殖細胞の体外培養系開発の最近の研究進展の経緯についても紹介したい.
マウスにおける生殖細胞の初期分化メカニズム
○生殖細胞の起源は始原生殖細胞(primordial germ cells,PGCs)にさかのぼる.哺乳類におけるPGCs 発生に関する研究は主にマウスをモデル動物として行われてきた.受精卵は着床後に多能性細胞であるエピブラストを形成し,発生6 日目にエピブラスト後方より原腸陥入が開始され,体細胞を形成する大元となる3 つの系譜(外胚葉,中胚葉,内胚葉)へと分化してゆく.PGCs は原腸陥入と同時期に上の3つの系譜とは独立した系譜からエピブラスト後方近位部にわずか数個の細胞集団として誘導される(図1).
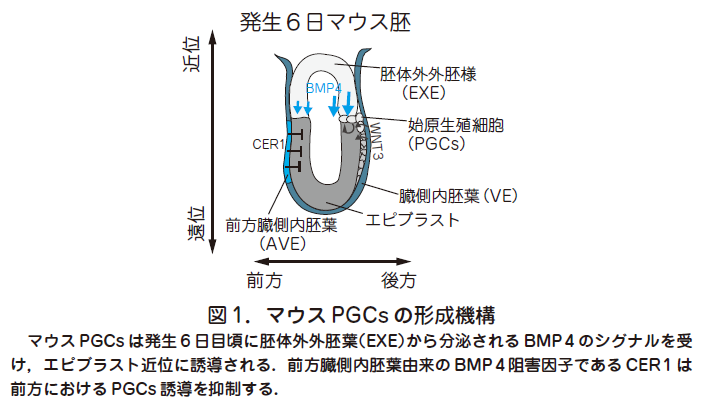
○古典的移植実験により原腸陥入前のエピブラストは全般的に生殖細胞への分化能を有しており,胚体外からのシグナルによって生殖細胞になるか,もしくは体細胞になるかの運命決定が行われることが分かっている.
この際に, 胚体外外胚葉(Extraembryonic ectoderm,ExE)から分泌されるBMP4やエピブラスト,臓側内胚葉(Visceral endoderm,VE)より分泌されるWNT3が必要であることが遺伝学的解析から判明し,またこれらの抑制因子(CER 1,DKK 1)が前方臓側内胚葉(anterior visceral endoderm,AVE)より分泌されることにより, 前方におけるPGCs 形成を抑制している(図1)(Lawson et al.Genes Dev 1999 , 13 : 424 ;Ohinata et al. Cell 2009, 137 : 571).このことは, マウスにおいて生殖細胞が後生的に外部からのシグナルをうけてエピブラストから発生することを示している.卵形成過程で蓄積,局在した母性決定因子によって生殖細胞への運命決定が起こるショウジョウバエなどのいくつかの動物種とは異なり,マウスでは多能性細胞を用いた外的シグナルによる人為的誘導の可能性を示唆している.我々は単一細胞遺伝子発現解析法を用いて,形成直後のPGCs と周辺の体細胞の比較を行い,マウスにおけるPGCs 特異的に発現する遺伝子や運命決定に重要な遺伝子を複数同定してきた(Saitou et al. Cold Spring Harb Perspect Biol. 2012 , 4(11)).これらの初期PGCs 特異的遺伝子に属するBlimp 1 やStella 制御下に蛍光タンパク質mVenus およびECFP を発現するレポーター遺伝子(Blimp 1 -mVenus とStella-ECFP:BVSC)を有するマウスを作製することで,PGCs の可視化が容易となり,詳細な動態が解析可能となった.エピブラスト内部で形成されたPGCs は発生7 日目に尿膜基底部の胚体外中胚葉領域に移動し細胞塊を形成,その後内胚葉へと移動を行い,最終的に後腸,腸間膜というルートを遊走することで,生殖巣(胎生期の精巣や卵巣)に至る.そこで生殖巣内の雌雄分化した体細胞からのシグナルを受け,雌雄それぞれに固有な分化を開始することで,最終産物である精子や卵子へと分化してゆく.
マウスPGCs の試験管内分化誘導系の確立
○ PGCs は胚発生初期にのみ存在する一過性でかつ希少な細胞群であるため,生化学的,分子生物学的解析は限定されており,ES 細胞などの多能性細胞から大量に体外で分化誘導する系の確立が望まれていた.以前から多能性幹細胞からPGCs を誘導する試みはなされてきたが,多くはランダムに分化させたES 細胞から生殖細胞発生の後期に発現を開始する遺伝子を指標にPGCs を検出するという方法であり,誘導効率が極めて低く(~1 %),またこれらが実際に機能的な精子や卵子として健常な個体発生に寄与するかという点もほぼ検証されることはなかった(Saitou et al.Cell Stem Cell 2016,18 : 721).これは複雑な発生段階を経て分化する生殖細胞形成機構を段階的に模倣できていないという点に問題があり,これらの発生段階をひとつずつ確実に体外培養に置き換えていくという方向で研究を進めていく必要性があった.
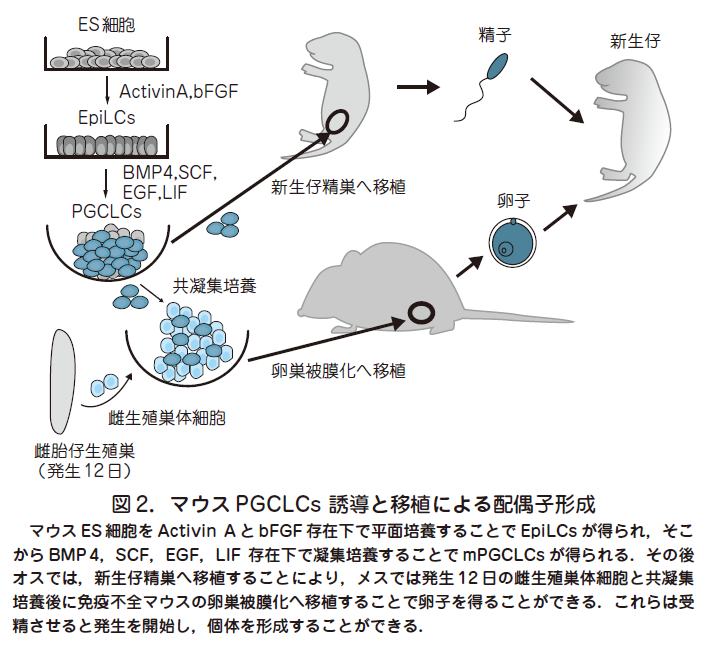
○そこで我々はまずPGCs 発生のごく初期段階に注目し,BVSC マウスの発生6 日胚よりエピブラストを単離し,そこに前述の液性因子であるBMP4や他の増殖因子(SCF,EGF,LIF, BMP8b)を添加することにより試験管内でBVSC 陽性で,かつ初期PGC に極めてよく類似した遺伝子発現やエピゲノムのパターンを有するマウス始原生殖細胞様細胞の誘導に成功した(Ohinata et al. Cell 2009,137 : 571).ここで重要な点はマウスへの移植により,PGCs を機能的な精子へと分化させる系がすでに確立されてきていたことである(Chuma et al. Development 2005 , 132 : 117).この系を用いて,誘導した始原生殖細胞様細胞を自身の生殖細胞を欠損したc-kit変異(W/Wv)マウス新生仔の精細管内へ移植することにより,機能的な精子への分化を認め,顕微受精により健常な産仔を得ることに成功した.
○次に我々はマウスES 細胞(BVSC-ES 細胞)を用いてマウス始原生殖細胞様細胞(mouse primordial germ cell-like cells,mPGCLCs)の誘導を試みた.マウスES 細胞は発生4 日目の内部細胞塊に類似したいわゆるナイーブ型の多能性細胞と考えられており,PGCs が誘導される発生6 日目のプライム型の多能性細胞であるエピブラストとは異なる.そこで,BVSC-ES 細胞をActivinA とbFGF を含む培地で2 日間培養することで, エピブラストとよく類似した遺伝子発現パターンを有するエピブラスト様細胞(Epiblast-like cells,EpiLCs)を得ることに成功した(図2)(Hayashiet al. Cell 2011, 146 : 591).EpiLCs は上記のmPGCLCs 誘導条件によってBMP4依存的に生体内PGCs と極めて類似した遺伝子発現やエピゲノムパターンを有するBVSC 陽性のmPGCLCs に誘導でき,これをW/Wv マウス新生仔の精細管内へ移植するとmPGCLCs 由来の精子形成を認め,顕微授精により妊孕性を有する健常な個体を得た(図2).iPS 細胞から誘導したmPGCLCs においても同様の機能的精子形成が確認された.また,我々はmPGCLCs を発生12 日目の雌生殖巣(将来の卵巣)の体細胞と共培養し,それを免疫不全マウスの卵巣内へ移植することによりmPGCLCs 由来の機能的な卵子を得ることにも成功している(図2)(Hayashi et al.Science 2012,338 : 971).以上から,ES 細胞やiPS 細胞などの多能性細胞から実際のPGCs 形成過程を正確に模倣した系を用いることにより機能的な配偶子を得ることが初めて可能となった.
ヒトPGCs の試験管内分化誘導研究における障壁とこれまでの経緯
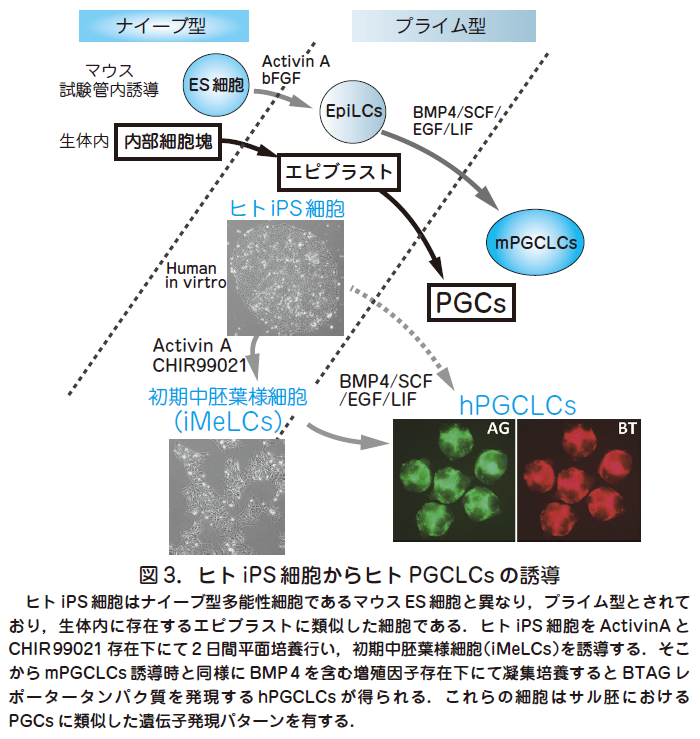
○ mPGCLCs の誘導と機能的な配偶子作製が可能となったことから,ヒトにおいても同様の系の確立に向けた動きは当然の流れといえる.特にヒトにおいてはPGCsが形成されると考えられている胚齢2 週目の胚を用いた解析は倫理的に不可能であるため,PGCs 形成過程の分子機構解明には試験管内誘導によるPGCLCs を用いた解析が必要不可欠である.生殖細胞形成機構の解明は大きな臨床的意義をもち,生殖細胞形成不全による不妊や生殖細胞発生異常に起因する先天性疾患,例えばトリソミーなどの原因解明につながる重要な評価系となる可能性がある.また,精子や卵子形成に問題のある配偶子型不妊症に対する治療法としても期待できる.一方,ヒトPGCs の試験管内分化誘導にはマウスの場合にはなかったいくつかの困難が予想される.まず,マウスの場合と異なり,ヒトPGCs が実際にどのように形成されるのかというデータがほぼ皆無であるため,試験管内誘導にて得られた産物との比較検討による評価ができないという点が挙げられる.マウスにおけるPGCs およびPGCLCs 形成を参照にすることは有効な方法ではあるが,ヒトとマウス間の初期形態形成における種差を考慮すると単純に適応することは困難であると思われる.例えば,マウスとヒトにおいてはES 細胞の性状が異なっていることが知られており,マウスES 細胞は発生4 日目の内部細胞塊に相当するナイーブ型,ヒトES 細胞は着床後のエピブラストに相当するプライム型と考えられている.プライム型であるヒトES 細胞は, マウスにおいては同じくプライム型であり,生殖細胞への分化能がないとされるエピブラスト幹細胞(epiblast stem cells,EpiSCs)と形態上,および遺伝子発現においても似ている.
一方で相違点もあり,果たしてヒトES 細胞やiPS 細胞が生殖細胞への分化能を有しているかは不明である(Saitou et al. Cell Stem Cell 2016 , 18 : 721).
○また,PGCs 形成を含めた着床後形態形成機構もヒトとマウスで大きく異なることが予想される.例えば,U 字型のエピブラストを有するマウス胚とは対照的にヒトのエピブラストは扁平な胚盤であり,またマウスにおけるPGCs 形成に必須な因子であるBMP4を分泌する胚体外外胚葉(Extraembryonic ectoderm,ExE)に相当する構造が存在しないことなどを考えると,マウス胚における遠近,前後軸にそったPGCs 形成機構をそのままヒトに当てはめることは困難であると考えられる(図1,3 参照).
○ 2010 年5 月10 日施行の「ヒトiPS 細胞又はヒト組織幹細胞からの生殖細胞の作成を行う研究に関する指針」はヒトiPS 細胞を用いた研究目的に限り,PGCs を誘導することを認めているものの,試験管内誘導された生殖細胞由来の胚作製は明確に禁止している.したがって,本邦において,iPS 細胞からヒト生殖細胞を造成した場合,それを受精させ,その初期胚発生能などを指標とする誘導産物の機能評価を行うことはできない.これも本邦においてiPS 細胞由来ヒト生殖細胞造成研究を行う上での大きな障壁であるといえる.
○これまでにもヒトES 細胞やiPS 細胞から生殖細胞を誘導するという試みは多く報告されている.多くはマウスの場合と同様に後期PGCs マーカーであるDDX4や減数分裂期マーカーなどを指標にES 細胞からランダムに誘導しており,誘導効率の低さと生体内におけるPGCs との比較を含めた厳密な性状解析がなされていないという致命的な問題点を有していた(Saitou et al. Cell Stem Cell 2016 , 18 : 721).
○これらの障壁を予想し,我々は系統発生上,ヒトに近く,かつ初期発生機構がヒトに類似したカニクイザルをモデルとして用いることで,ヒトでは得ることのできない遺伝子発現やエピゲノム修飾を含めた霊長類PGCs 形成における生体内の知見を得ることを考えた.その情報を基に順次ヒトiPS 細胞から試験管内誘導した細胞における遺伝子発現や,エピゲノムデータとそれに対応するカニクイザルPGCs のデータを厳密に比較し,その正常性の検証を行うことで正確にかつ段階的にヒトPGCs 形成を試験管内再構築してゆくという方法で研究を開始した.
ヒトPGCs の試験管内分化誘導
○我々はまず,mPGCLCs と同様にヒトiPS 細胞を起点としてPGCs 固有の遺伝子発現を有する細胞の誘導を試みた(図3)(Sasaki et al. Cell Stem Cell 2015,17 : 178).その際,誘導した細胞を可視化し定量的に評価するため,マウス初期PGCs 形成に必須であり,かつヒトの胎児生殖巣内の後期生殖細胞においても発現が報告されている2 つの遺伝子(BLIMP1とTFAP2C)の制御下に各々異なる2 種類の蛍光タンパクを発現するレポーター遺伝子BLIMP1-2 A-tdTomato(BT)とTFAP2C-2AEGFP(AG)を導入したヒトiPS 細胞株を樹立した.この細胞株はフィーダー細胞非存在下で培養でき,遺伝子発現解析の結果,正常な染色体とプライム型の遺伝子発現を有することが分かった.この細胞を直接BMP4を含むmPGCLC 誘導と同様の培地で凝集培養したところ,やや低い効率(~20 %)ではあるが,BT,AG 陽性細胞が4 日目までに誘導されることが分かった.そこで,培養条件のさらなる改良を行い,ActivinA とCHIR99021 という増殖因子の存在下にまずiPS 細胞を2 日間,平面培養し,中胚葉分化に特徴的な遺伝子を一部発現する初期中胚葉様細胞(incipient mesoderm-like cells,iMeLCs)を誘導した.ここからさらにBMP4を含む培地で凝集培養することで,2 日以内にBT およびAG が誘導され,少なくとも12 日まで維持される細胞を高効率(30~60 %)に得ることに成功した(図3).これらの細胞の遺伝子発現をトランスクリプトーム解析にて詳細に検討したところ,カニクイザル胚の生殖巣より得られたPGCs とよく類似した遺伝子発現パターンを有することからヒトPGC 様細胞(human PGC-like cells,hPGCLCs)と命名された.一方でhPGCLCs はDDX4,DAZL などの後期PGCs に特徴的な遺伝子を発現しておらず,形成初期のPGCs に相当すると考えられた.以上の結果はプライム型の多能性幹細胞であるヒトiPS 細胞は生殖細胞への分化能を有している可能性を示唆しており,従来マウスをモデルとして提唱されてきたプライム型多能性細胞は生殖細胞分化能を有さないという概念に反立する結果となった.実際,トランスクリプトーム解析によるマウスのES 細胞,EpiLCs,EpiSs とヒトiPS 細胞の比較検討を行ったところ,ヒトiPS 細胞はEpiLCs とEpiSCs の中間の遺伝子発現パターンを有することが分かり,種間によるプライム型多能性状態の多様性が示唆される結果となった(図4).
○以上に述べたhPGCLCs 誘導系はレポーター遺伝子発現を指標に細胞の単離と解析を行ってきたわけだが,レポーター遺伝子を有さない細胞からhPGCLCs を誘導し単離するためには別の指標が必要となる.我々はBTAG 細胞を用いて,様々な細胞表面抗原の発現を検討した結果,インテグリンa6(ITGA6)とEpCAM を共発現する分画とBTAG 分画がほぼ一対一に対応することを見出した.この細胞表面マーカーを用いることで,様々なヒトiPS 細胞株からhPGCLCs を効率よく誘導でき,これらは先述のBTAG 由来hPGCLCs とほぼ同等の遺伝子発現パターンを有することが分かった.以上から我々の誘導系が効率のよいかつ再現性の高い系であることが判明した(Sasaki et al. Cell Stem Cell 2015,17 : 178).
○我々と同時期にイギリスのSurani らのグループから同様のヒトPGCLCs 誘導系の報告がなされた(Irie et al. Cell 2015,160 : 2539).彼らはまず,ヒトES 細胞,iPS細胞をナイーブ型にまき戻すために4 i 条件と呼ばれる4 つのシグナル阻害剤の混合による処理を行った後に,mPGCLCs 誘導とほぼ同様の方法で比較的効率よく(20~50 %)hPGCLCs を誘導しており,一方で通常の培養条件のプライム型ES 細胞からBMP4を用いて直接誘導した場合にはほぼ誘導がかからなかったと述べている.これはプライム型iPS 細胞から効率よくhPGCLCs を誘導できるという我々の見解と反する結果である.しかし,トランスクリプトーム解析による比較により彼らの条件で誘導されたhPGCLCs は我々の系で誘導されたhPGCLCs とよく似た遺伝子発現パターンを有していることが判明している.さらなる詳細な遺伝子発現解析から,彼らの4 i 条件下で培養されたES 細胞やiPS 細胞は実は彼らの意図に反してナイーブ型にはなっておらず,中胚葉系の遺伝子を発現しており,我々のiMeLCs に近い状態を経てhPGCLCs になっている可能性が示唆された.
ヒト生殖細胞形成メカニズム
○試験管内におけるhPGCLCs 分化誘導の利点として,遺伝子変異の導入による機能的解析が可能である点が挙げられる.我々はBLIMP1というマウスPGCs 形成に必須な因子に注目し,iPS 細胞においてTALEN というゲノム編集技術を用いて遺伝子を欠損させ,そこからhPGCLCs を誘導することで生殖細胞形成過程におけるBLIMP1の役割を検討した.その結果,BLIMP1欠損株ではBTAG 陽性細胞は出現するものの,4 日間以上維持できず,6 日目にはほぼ消失していた.遺伝子発現解析の結果,BLIMP1はPGCs 形成に必要な遺伝子サーキットを活性化させ,神経分化を抑制することが判明した(Sasaki et al. Cell Stem Cell 2015,17 : 178).Surani らのグループはhPGCLCs 形成においてBLIMP1のさらに上流の遺伝子としてSOX17を同定している(Irie et al. Cell 2015,160 : 2539).マウスPGCs においてSOX17は最初期を除いて発現はみられず,一方で同じ遺伝子ファミリーに属するSOX2を発現する.逆にhPGCLCs やヒトPGCs においてSOX2の発現は消失しており,種間におけるPGCs 形成機構の差の一例として大変興味深い.今後,hPGCLCs の系を用いて同様の機能的解析が進み,ヒトPGCs 形成の基盤となる分子ネットワークが急速に明らかになってくることが予想される.
霊長類におけるPGCs の起源と発生機序
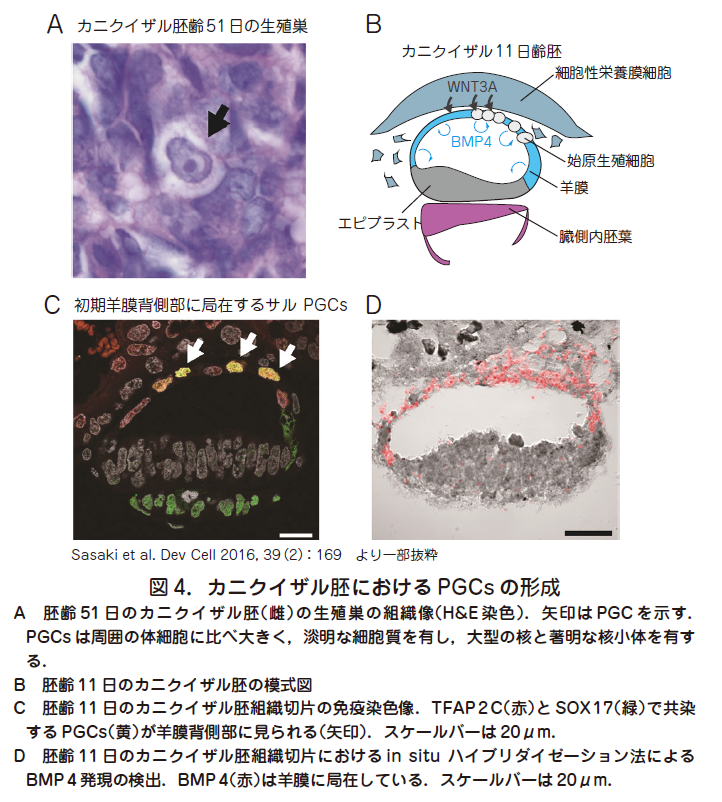
○実際,ヒト胚発生時にPGCs がどこで,どのように形成されるかに関してはほとんど分かっていない.これは先述のとおり,着床後まもなく(胚齢2 週頃)開始されるPGCs 形成に関してヒト胚を用いて解析するのは倫理的にも技術的にも困難であるからである.古典的な記述によると,発生3 週目頃に卵黄囊背側の内胚葉内部にPGCs と思われる細胞集団が出現すると記載されている.これは現在まで報告された最も早い発生段階におけるヒトPGCs に関する記述である(Fuss Anat Am. 1911,39 : 407 ; Witschi Contrib. Embryol. Carnegie Inst. 1948,209 : 67).そこで我々はカニクイザル胚を霊長類PGCs 形成におけるモデルとしてPGCs の起源と発生段階におけるPGCs 特異的遺伝子発現を詳細に検討した(Sasaki et al. Dev Cell 2016,39 : 169).まず,比較的入手が容易な胎齢40~50 日目の胎仔生殖巣の組織切片を免疫染色法用いて評価し特徴的な形態(淡明な細胞質,大型の核と著明な核小体)を有する大型の細胞としてPGCs を同定した( 図4A).これらの細胞はBLIMP1,TFAP2C,SOX17,OCT4,NANOG などを含む複数のPGCs 特異的遺伝子を共発現していた.これらをPGCs の指標として用いて,より早い発生各時期におけるPGCs の局在を調べたところ,驚くべきことにPGCs 形成は胚齢11 日目までさかのぼり,10~20 程度の細胞集団として初期羊膜背側部において初めて観察され(図4B,C),その後17 日齢頃までに羊膜後方より卵黄囊内胚葉へ移動することが判明した.初期羊膜はそれ自体でPGCs 誘導因子であるBMP4(図4D)やBMP4のターゲット遺伝子であるID 2 やMSX 2 も発現していることから,自己分泌的作用により初期羊膜内部においてPGCs が形成される可能性が示唆された.これはPGCs がエピブラストから形成されるというマウスを中心に構築された概念を覆す重大な結果であるが,PGCs 起源に関する厳密な証明にはレポーター胚を用いたPGCs の可視化と体外胚培養下でのリアルタイム観察による追跡,胚の移植や切断などの発生生物学的実験を要するだろう.これらの技術は霊長類胚での適応の前例がなく,技術的に極めて困難であるのが現状である.
ヒト生殖細胞造成の近未来
○形成初期段階にあると考えられるhPGCLCs を今後どうやってさらに分化させ,精子や卵子までもってゆくかということが,今後の生殖細胞造成の鍵を握っていると思われる.
○ mPGCLCs から機能的な精子や卵子を得た場合のように,ヒトやサル生殖巣体細胞と共凝集したhPGCLCs をマウスの生殖巣や皮下などに移植を行うという手法も考えられる.メリットとしては生体環境を直接利用できるため詳細な条件検討が不要である点であるが,デメリットとして,異種間移植であるために臨床応用には向かない点と,ヒト配偶子が異種の動物体内で形成されてしまった場合の倫理面での懸念が想定されることが挙げられる.PGCs の異種間移植による分化誘導はヒトにおいては成功例がなく,hPGCLCs を用いる前にヒト胎児から単離したPGCs を用いた詳細な検討が必要と考えられる(Dores et al. Cell Tissue Res. 2012,349 : 691).これらのヒト生殖細胞の分化誘導系の確立をめざす上で,ヒト胎児から得られた各発生段階におけるPGCs や生殖巣体細胞に関する情報は必要不可欠であり,内包する倫理的問題を考えて慎重な対応が望まれる一方で,中絶胎児由来組織を希少なバイオリソースとして複数の研究室で効率的に利用してゆく研究体制を今後組んでいく必要があると考えられる.
○一方,先述のmPGCLCs 由来配偶子作製はmPGCLCs 誘導以降の発生段階はマウスへの移植を介しており,マウス胎内環境に依存していたが,これを少しずつ試験管内誘導系に置換してゆく試みが急速に展開されてきている.驚くべきことに最近,雌マウスPGCs,もしくはES 細胞由来PGCLCs と雌生殖巣体細胞を共凝集した後,発生段階を体外分化培養,体外発育培養,体外成熟培養の3 ステップに分け,各段階の条件を検討することにより5 週間かけてすべての段階を試験管内で再現し,機能的な卵子の試験管内誘導とその体外授精による健常な産仔作製に成功したという報告がなされた(Morohaku et al. Proc Natl Acad Sci USA 2016,113 : 9021 ;Hikabeet al. Nature 2016,539 : 299).この成果は生殖細胞分化の多くのステップを試験管内誘導系により再現できることを意味しており,ヒト生殖細胞造成に向けてさらに期待がふくらむ.一方で,これらの成果を単純にヒトに適応するのは困難を伴うことが予想される.まず,マウス胎内においては数週間で完了する精子や卵子の発生はヒトでは1 年近くかかるため,ヒトの発生時間軸に沿った分化誘導系の調整が必要となる.各発生段階における複数の条件検討を繰り返すことを考えると完成までに相当な年月を有する可能性がある.また,この体外培養系はマウス生殖巣体細胞との共培養を必要としているが,ヒト生殖細胞とマウス生殖巣体細胞間ではヒト生殖細胞分化に必要な相互作用が十分に起こらない可能性が高く,一方でヒトやサル胎児生殖巣は入手が容易ではないため,生殖細胞誘導の条件検討の際に大量に調整が必要となると予想される生殖巣体細胞の供給源としては最適とはいえない.ヒトiPS 細胞からヒト生殖巣体細胞が誘導可能になれば,上述のマウスと同様な系を用いてhPGCLCs のさらなる試験管内分化誘導に向けた詳細な条件検討が可能になる上,生体材料に依存しない点でより臨床を見据えた実践的なヒト生殖細胞誘導系の確立につながるだろう.
○成体雄の精巣には精子の元になる精原幹細胞が存在しており,自己複製しつつ分化を行い無数の精子を長期的に産生することができる幹細胞としての能力を有している.マウスにおいて,この細胞を幹細胞としての性状を維持したまま試験管内にて長期的に増殖,株化させることが可能であり,生殖幹細胞株(Germ-line stem cells,GSCs)と命名されている(Kanatsu-Shinohara et al. Biol Reprod. 2003 , 69 : 612).この細胞は成体雄の精巣へ移植すると精子に分化することが知られている.
○我々は最近,雄生殖巣体細胞との共凝集後に,試験管内で雄mPGCLCs を精原細胞(出生後精子へと分化する直前にみられる雄生殖細胞)まで分化誘導させ,さらにそれを長期培養可能な生殖幹細胞様細胞(Germ-line stem cell-like cells,GSCLCs)として株化することに成功している(Ishikura et al. Cell Rep 2016,17 : 2789).この細胞株を生殖細胞を欠損する成体マウスに移植することで機能的な精子が得られることが分かった.小川らのグループによると新生胎仔精細管内にGSCs を移植した後,精巣を組織ごと培養することで機能的な精子を得ており(Sato et al. Nat.Commun. 2011 , 2 : 472),上の我々の研究と合わせると,原理的には雄の生殖細胞形成の全工程を試験管内にて再構築可能な段階まできている.残念ながら,ヒトにおいてはまだ再現性の高いGSCs の培養法や精巣組織培養法も確立しておらず,そのためにもヒトやサルの精巣組織内における精原幹細胞の詳細な性状解析と精原幹細胞維持に必要なニッチ形成機構の解明が待たれる.
○いずれにしても昨今の急速な生殖細胞体外培養系の進歩を考えると,近い将来,おそらく10 年以内にヒトiPS 細胞由来配偶子造成に至るのではと予想される.しかし,次世代の個体を形成する生殖細胞特有の性質を考慮すると,不妊治療などの臨床応用に移る前に,厳密な安全性と有効性の検証が必要となるだろう.具体的には造成した配偶子の遺伝子レベルやエピゲノムレベルでの徹底的な性状解析と着床前初期発生の検証,サルを用いた造成配偶子由来個体の数世代にわたる正常性の検証などを行う必要がある.これにはかなり長い年月を有することが予想される.また,皮膚などの体細胞はiPS 樹立前にすでに多くの突然変異を獲得していることが知られてきている.精子や卵子などの生殖細胞では何らかの機構によりこれが最小限に抑えられていると考えられている.したがって,iPS 細胞を用いた生殖細胞の造成はこれらの有害な突然変異を次世代にもち越す危険性を秘めており,全ゲノムシークエンスによる徹底した品質管理が求められるだろう.この技術を行う上で,そのような危険な突然変異の回避がそもそも非現実的である可能性も考えられ,その場合は急速に発展しつつあるゲノム編集技術を用いた突然変異の修復も考慮されることになる.そうなれば,体細胞突然変異と個体発生時にすでに存在していた生殖細胞突然変異をどこまで厳密に区別し修復するかなどが問題になり,近年話題となっている「デザイナーベイビー」(生殖細胞に遺伝子操作を行うことで生み出された親の望む形質をもった子供)と表裏一体の技術であることになる.その場合,やはり倫理面からさらに慎重な議論が必要となってくるだろう.

